
| 化学键 | H-H | C=C | C-C | C≡C | C-H |
| E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
分析 甲烷一步生产链烃乙烯、芳烃Y和Z,反应过程本身实现了CO2的零排放,即碳原子守恒,Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种,故Y为苯,Z为(CH3)3CCH2C(CH3)3,
(1)①甲烷一步生成CH2=CH2,断裂碳氢键,形成碳碳双键,据此书写热化学方程式;催化剂在反应中可以降低反应的活化能;
②甲烷生成苯的反应方程式为6CH4→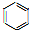 +9H2,根据苯的原子质量除以反应物中原子总质量计算原子利用率;
+9H2,根据苯的原子质量除以反应物中原子总质量计算原子利用率;
③甲烷生成(CH3)3CCH2C(CH3)3的反应方程式为9CH4→(CH3)3CCH2C(CH3)3+8H2,故生成1mol(CH3)3CCH2C(CH3)3同时生成8molH2,并据V=nVm计算体积;
(2)①列出Kp表达式,利用三段法计算平衡分压带入表达式计算即可;
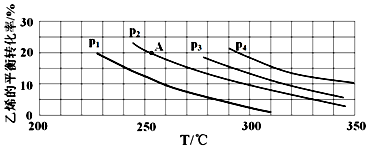
②该反应是化合反应,故为放热反应;在相同温度下由于乙烯转化率为p1<p2<p3<p4,由C2H4(g)+H2O(g)→C2H5OH(g)可知正反应为气体体积减小的反应,根据压强对平衡移动的影响分析;
③若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度;
(3)负极失电子发生氧化反应书写电极反应方程式.
解答 解:甲烷一步生产链烃乙烯、芳烃Y和Z,反应过程本身实现了CO2的零排放,即碳原子守恒,Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种,故Y为苯,Z为(CH3)3CCH2C(CH3)3,
(1)①甲烷一步生成CH2=CH2,断裂碳氢键,形成碳碳双键,根据题中化学键的键能数据可知该反应的反应热△H=(8×413.4-4×413.4-615-2×436.0)kJ/mol=+166.6kJ/mol,所以热化学方程式为2CH4(g) $\stackrel{催化剂}{→}$C2H4(g)+2H2(g)△H=+166.6kJ/mol;硅化物晶格限域的单中心铁催化剂的作用是降低反应的活化能,加快反应的速率,
故答案为:2CH4(g) $\stackrel{催化剂}{→}$C2H4(g)+2H2(g)△H=+166.6kJ/mol;降低反应的活化能,加快反应的速率;
②甲烷生成苯的反应方程式为6CH4→ +9H2,所以原子利用率为$\frac{78}{6×16}$×100%=81.25%,
+9H2,所以原子利用率为$\frac{78}{6×16}$×100%=81.25%,
故答案为:81.25%;
③甲烷生成(CH3)3CCH2C(CH3)3的反应方程式为9CH4→(CH3)3CCH2C(CH3)3+8H2,故生成1mol(CH3)3CCH2C(CH3)3同时生成8molH2,故V(H2)=n(H2)Vm=8mol×22.4L/mol=179.2L,
故答案为:179.2;
(2)①C2H4(g)+H2O(g)═C2H5OH(g)
开始:1 1 0
转化:0.2 0.2 0.2
平衡:0.8 0.8 0.2
乙醇占$\frac{0.2}{0.8+0.8+0.2}$=$\frac{1}{9}$,乙烯和水各占 $\frac{0.8}{0.8+0.8+0.2}$=$\frac{4}{9}$,则乙醇的分压为8MPa×$\frac{1}{9}$=$\frac{8}{9}$MPa,乙烯和水的分压为8MPa×$\frac{4}{9}$=$\frac{32}{9}$MPa,
所以Kp=$\frac{p({C}_{2}{H}_{5}OH)}{p({C}_{2}{H}_{4})•p({H}_{2}O)}$=$\frac{8MPa}{\frac{8}{9}MPa×\frac{32}{9}MPa}$=2.53(MPa)-1,
故答案为:2.53(MPa)-1;
②该反应是化合反应,故为放热反应;在相同温度下由于乙烯转化率为p1<p2<p3<p4,由C2H4(g)+H2O(g)═C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1<p2<p3<p4,
故答案为:放热;p1<p2<p3<p4;反应分子数减少,相同温度下,压强升高乙烯转化率提高;
③若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度,改变二者物质的量的比等,
故答案为:将产物乙醇液化移去,或增大水与乙烯的比例;
(3)负极失电子发生氧化反应,故电极反应方程式为C2H4-12e-+6CO32-=8CO2+2H2O,
故答案为:C2H4-12e-+6CO32-=8CO2+2H2O.
点评 本题考查了化学方程式的书写、压强对平衡移动的影响、物质制取方案的比较、电极方程式的书写,综合性非常强,该题是高考中的常见题型,属于中等难度较大,侧重于学生分析问题、解决问题、知识迁移能力的培养.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| B. | 在25℃、101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ/mol | |
| C. | 在25℃、101kPa时,1molC与适量O2反应生成1molCO其它时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
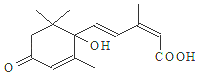 国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )| A. | 分子式C15H21O4 | |
| B. | 既能发生加聚反应,又能发生缩聚反应 | |
| C. | 1mol该物质与H2加成,最多消耗5molH2 | |
| D. | 既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | a | b |
| 试剂 | 0.1mol/L Fe(NO3)3 | 0.05mol/L Fe2(SO4)3 |
| 现象 | 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 | 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 |
| 实验方案 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该结构二氯代物有3种(不考虑立体异构).
,该结构二氯代物有3种(不考虑立体异构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
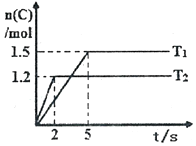 现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )
现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )| A. | T1<T2 | |
| B. | 该反应在温度为T1时达到平衡时,容器中A与C的物质的量浓度相等 | |
| C. | 温度为T2时,2s内B的平均速率为0.3mol•L-1•s-l | |
| D. | 温度为T1时,达平衡时反应物A的转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应2A(s)+B(g)?2C(g)△H>0 能自发进行,原因是△S<0 | |
| B. | 催化剂能改变反应的途径,但不能改变反应的△H | |
| C. | S(g)+O2(g)═SO2(g)△H1<0 S(s)+O2(g)═SO2(g)△H2<0 则△H1>△H2 | |
| D. | 化学平衡CO(g)+H2O(g)$\stackrel{催化剂}{?}$CO2(g)+H2(g),增加H2O的浓度H2O的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,H2O电解产物H2和O2的物质的量之比为2:1 | |
| B. | 相同条件下,H2O电解产物H2和O2的质量之比为2:1 | |
| C. | 相同条件下,1molH2与1molO2的体积相同 | |
| D. | 相同条件下,1molH2与1molO2的质量不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com