
【题目】甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇时,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1= -99kJmol-1
CH3OH(g) △H1= -99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2= 58kJmol-1
CH3OH(g)+H2O(g) △H2= 58kJmol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41kJmol-1
CO(g)+H2O(g) △H3=+41kJmol-1
(1)一定温度下,向体积为2L的密闭容器中加入CO和H2,假设只发生反应①,达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①列式并计算平衡常数K=___。
②若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是___。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__v逆(填“>”、“<”或“=”)。
(2)在实际生产中,当合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示。
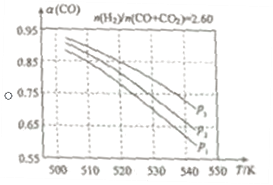
α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图中的压强由大到小为___,其判断理由是___。
【答案】![]() L2moL-2(或0.67L2 moL-2) 1molL-1<c(H2)<2molL-1 = 减小 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;从而得出:随温度升高,使CO的转化率降低 p3>p2>p1 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高
L2moL-2(或0.67L2 moL-2) 1molL-1<c(H2)<2molL-1 = 减小 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;从而得出:随温度升高,使CO的转化率降低 p3>p2>p1 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高
【解析】
(1)①平衡常数K=![]() ,代入表中数据即可求出K。
,代入表中数据即可求出K。
②若将容器体积压缩为1L,预测c(H2)的取值范围,若平衡不移动,c(H2)=2.0mol/L,当平衡移动达新平衡后,c(H2)>1.0mol/L(平衡移动只能减弱这种改变,所以比原平衡时的浓度大),最终c(H2)介于两个极端点之间。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,利用浓度商与K进行比较,确定平衡移动的方向,从而确定v正与v逆的相对大小。
(2)从图中可以看出,α(CO)值随温度升高而减小,其原因可从①CO(g)+2H2(g)![]() CH3OH(g) △H1= -99kJmol-1 ③CO2(g)+H2(g)
CH3OH(g) △H1= -99kJmol-1 ③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41kJmol-1两个反应进行分析。图中压强的大小关系仍可从①、③两个反应进行分析。
CO(g)+H2O(g) △H3=+41kJmol-1两个反应进行分析。图中压强的大小关系仍可从①、③两个反应进行分析。
(1)①平衡常数K=![]() =
=![]() L2moL-2(或0.67L2 moL-2);答案为:
L2moL-2(或0.67L2 moL-2);答案为:![]() L2moL-2(或0.67L2 moL-2);
L2moL-2(或0.67L2 moL-2);
②若将容器体积压缩为1L,可预测c(H2)的取值范围。若平衡不移动,c(H2)=2.0mol/L,当平衡移动达新平衡后,c(H2)>1.0mol/L(平衡移动只能减弱这种改变,所以比原平衡时的浓度大),最终c(H2)介于两个极端点之间,即1molL-1<c(H2)<2molL-1;答案为:1molL-1<c(H2)<2molL-1;
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,浓度商Q=![]() =K,所以平衡不发生移动,从而确定v正=v逆。答案为:=。
=K,所以平衡不发生移动,从而确定v正=v逆。答案为:=。
(2)从图中可以看出,α(CO)值随温度升高而减小,其原因为:升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;从而得出:随温度升高,使CO的转化率降低。
对于反应①,压强大则CO的转化率大,对于反应③,压强改变平衡不发生移动,CO的转化率不变,所以,CO转化率大,则表明压强大,由此可得p3>p2>p1;其判断理由是:
相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高。答案为:减小;升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;从而得出:随温度升高,使CO的转化率降低;p3>p2>p1;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高。


科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):

根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1B.反应Ⅱ:ΔH>0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1D.反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 0.5molA 1.5 molB | 0.5 molA 1.5 molB | 2.0 molA 6.0 molB |

下列说法正确的是
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.l0min内甲容器中反应的平均速率v(B)=0.025mol·(L·min)-1
D.T1℃,若起始时甲容器中充入1.5molA、0.5molB,平衡时B的转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)室温下在pH =5的醋酸稀溶液中, 醋酸电离出的c(H+)的精确值是__molL-1,水电离出的c(H+)是__molL-1。
(2)写出下列反应的离子方程式:①草酸溶液中滴入酸性高锰酸钾溶液___;
②铬酸钾溶液中滴入稀硫酸___;
(3)反应I2+2S2O32-=2I-+S4O62-常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择___(填序号)。
①1mL0.01molL-1的碘水 ②1mL0.001molL-1的碘水
③4mL0.01molL-1的Na2S2O3溶液 ④4mL0.001molL-1的Na2S2O3溶液
若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32-)=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1=-221.0kJ/mol
2CO(g) △H1=-221.0kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5kJ/mol
2NO (g) △H2= +180.5kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3=-746.0 kJ/mol
2CO2(g)+N2(g) △H3=-746.0 kJ/mol
则用焦炭还原NO生成无污染气体的热化学方程式为___。该反应的平衡常数Kp=__(写表达式)。
(2)用NH3催化还原NOx也可以消除氮氧化物的污染。已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
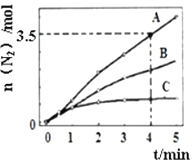
①在催化剂A的作用下,0~4min的v(NH3)=___。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是___,理由是__。
③下列说法正确的是__(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )

A.1:3B.2:3
C.6:1D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.“84”消毒液中,SiO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
B.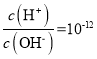 的溶液中NH
的溶液中NH![]() 、Ca2+、C1-、NO3-
、Ca2+、C1-、NO3-
C.0.1mol/LNaA1O2溶液中:HCO![]() 、NH4+、SO
、NH4+、SO![]() 、Fe3+
、Fe3+
D.pH=1的溶液中:Na+、K+、Cl-、S2O![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=xkJ·mol–1,不同条件下反应过程能量变化如图所示。下列说法中不正确的是( )
2SO3(g) ΔH=xkJ·mol–1,不同条件下反应过程能量变化如图所示。下列说法中不正确的是( )

A.反应的ΔH<0
B.过程b使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.过程b发生两步反应,第一步为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com