
I.下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。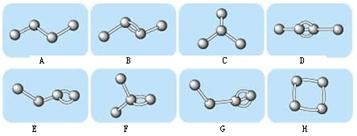
(1)图中属于烷烃的是 (填编号);属于烯烃的是 (填编号);
(2)上图中与B互为同分异构体但不属于同种类的物质的是: 。(填编号)
II.课本“交流?研讨”栏目有这样一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol氧气中的化学键需要吸收249kJ的能量;形成水分子中1 mol H—O键能够释放463kJ能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。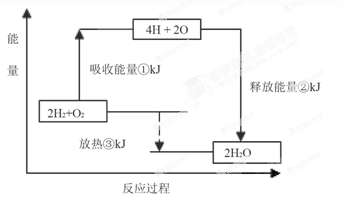
① kJ;② kJ;③ kJ。
(12分)I. AC BEF H II.①1370 ②1852 ③482(每空2分)
解析试题分析:(1)烷烃是只含有C—H键、C—C键的链状烃,不含C=C或C≡C或环状结构,可以含有支链结构,则图中A、C代表的烃(正丁烷、异丁烷)属于烷烃;烯烃是含有1个C=C和若干个C—H键、C—C键的链状烃,不能含有环状结构,可以含有支链结构,则图中B、E、F代表的烃属于烯烃;(2)根据碳四价规律,每个球表示1个碳原子,每个碳原子周围短线数+与碳原子相连的氢原子数目=4,则图中A、B、C、D、E、F、G、H的碳、氢原子数均可推断,其分子式分别为C4H10、C4H8、C4H10、C4H6、C4H8、C4H8、C4H6、C4H8,则与B互为同分异构体的是E、F、H,其中B、E、F均属于烯烃,而H属于环烷烃;
II.①由于破坏1mol氢气中的化学键需要吸收436kJ能量,破坏1/2mol氧气中的化学键需要吸收249kJ的能量,则破坏2mol氢气中的化学键需要吸收2×436kJ能量,破坏1mol氧气中的化学键需要吸收2×249kJ的能量,因此同时破坏2mol氢气和1mol氧气中的化学键需要吸收的总能量为2×436kJ +2×249kJ=1370kJ;②1个H2O分子含有2个H—O键,则2molH2O(g)中含有4molH—O键,由于形成水分子中1 mol H—O键能够释放463kJ能量,则形成2molH2O(g)中的4molH—O键能够释放的总能量为4×463kJ=1852kJ;③由于破坏2mol氢气和1mol氧气中的化学键需要吸收的总能量为1370kJ,形成2molH2O中的4molH—O键能够释放的总能量为1852kJ,1370kJ<1852kJ,则2mol氢气和1mol氧气反应生成2molH2O(g)时放出的热量为482kJ。
考点:考查有机物的组成结构及分类、化学反应中能量变化的原因,涉及含有4个碳原子的各种烃的键线式、结构简式、分子式、官能团、同分异构体,以及物质结构、化学键、化学键断裂需要吸收的能量、形成化学键可以释放的能量、物质的量、化学反应中的能量变化、化学方程式等。


科目:高中化学 来源: 题型:填空题
向2L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示[t0~15 s阶段n(B)未画出]。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段所改变的外界条件均不同。已知t3~t4阶段为使用催化剂。观察下图,回答以下问题: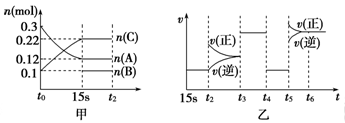
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为____________________。
(2)图乙中t2时引起平衡移动的条件是______,t5时引起平衡移动的条件是_______。(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.减少体系压强
(3)图乙中表示平衡混合物中,在这四个阶段中C的物质的量最高的一段时间是______。(填序号): A.15s-t2时段 B.t3-t4时段 C.t4-t5时段 D.t6以后
(4)该反应的化学方程式可以表示为:_______________________________________________________,
正反应为______________(填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g) CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
(1)已知:① CH4(g)+3/2 O2(g) CO(g)+2H2O(g)△Hl;
CO(g)+2H2O(g)△Hl;
② H2(g)+1/2 O2(g) H2O(g) △H2,
H2O(g) △H2,
则CH4(g)+ H2O(g) CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
(2)一定条件下反应CH4(g)+H2O(g) CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB
CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB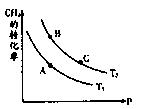
(3)维持温度T2,将0.04 mol CH4和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=____ ,下列现象能说明该反应已经达到平衡状态的是_ ___
a.容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3
b.容器的密度恒定
c.容器的压强恒定
d.3υ正(CO)=υ逆((H2)
(4)在上述B点平衡基础上,向容器中再通入amol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03mol,则a=____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学反应变化过程及结果的研究。按要求回答问题:
(1)关于反应过程中能量变化的研究:
则:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
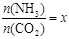 ,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。

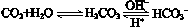 ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:| c(HCO3-)∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
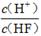 D.
D.
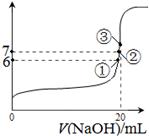
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
 2CO(g)+2H2(g) 的△H= 。
2CO(g)+2H2(g) 的△H= 。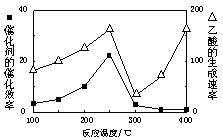
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢气是一种清洁、高效的新型能源。
I.用甲烷制取氢气的反应分为两步,其能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
II.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应。测得CO2的浓度随时间变化的图像如图: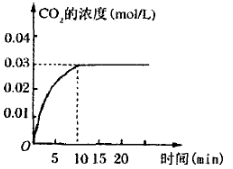
(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为 ;
(3)该温度下,此反应的化学平衡常数为(可以用分数表示) ;
(4)下列改变中,能使平衡向正反应方向移动的是 。
| A.升高温度 | B.增大压强 |
| C.增大H2O(g)的浓度 | D.减少CO2(g)的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
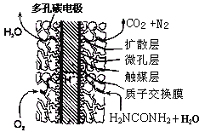
(16分)尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
请回答下列问题:
(1)操作I、II的名称分别是______、_______。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3KJ/mol、285.8kJ/mol
②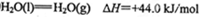
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:_______________。
(3)合成过氧化氢尿素加入的稳定剂可以是水杨酸、酒石酸等。酒石酸分子式为C4H6O6,其核磁共振氢谱只有3种锋,只含羧基和羟基两种官能团,则酒石酸的结构简式为_____。
(4)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMO4溶液与尿素不反应).
①完成并配平方程式: MnO4-+
MnO4-+  H2O2+
H2O2+  _________=Mn2++
_________=Mn2++ O2↑+
O2↑+ ___;
___;
②计算出产品中H2O2的质量分数为_______。
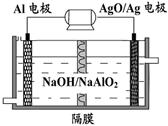
(5)电解尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,B两极均为惰性电极。B极连接电源的____极(填
“正”或“负”),阳极电极反应方程为_____________。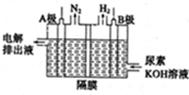
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 甲 | 乙 | 丙 | ||
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 | ||
| 达到平衡的时间/min | | 5 | 8 | ||
| 平衡时N2的浓度/mol·L-1 | c1 | 1.5 | | ||
| NH3的体积分数 | ω1 | | ω3 | ||
| 混合气体密度/g·L-1 | ρ1 | ρ2 | |
 H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2 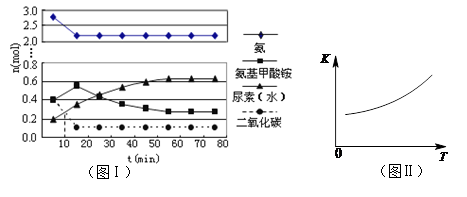
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com