
【题目】下列有关说法正确的是
A. 当H2O与Na2O2反应生成1molO2时,转移的电子数目为2×6.02×1023
B. 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C. 常温下2S2O(g)![]() 3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
D. 氯水通入SO2后溶液的酸性减弱
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1NaOH溶液滴定20mL0.1000mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是

A.当滴入40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
B.当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+)
C.当滴入NaOH溶液20mL时c(OH-)>c(H+)+c(HA)
D.当滴定到pH=4.75时,c(A-)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是

A. 图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为FeSO4
B. 原溶液中H2SO4浓度为2.5 mol·L-1
C. 原混合溶液中NO3-的物质的量为0.2 mol
D. 图中,OA段产生的气体是NO,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O22SO3,其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
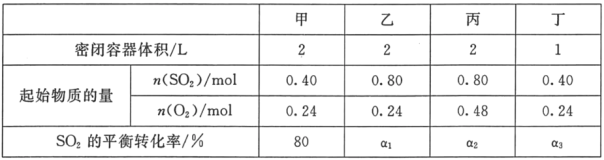
A.该温度下,该反应的平衡常数K为400
B.SO2的平衡转化率:a1>a2=a3
C.达到平衡时,容器丁中的正反应速率比容器丙中的大
D.达到平衡时,容器丙中c( SO3)大于容器甲中c( SO3)的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如图1:

已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10﹣13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
③六价铬在溶液中物种分布分数与pH关系如图2所示。

④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
(1)实验时需要配置100mL3molL﹣1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要玻璃仪器是___。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是_____。
(3)“氧化”时H2O2滴加速度不宜过快,其原因是_____;“氧化”时发生反应的离子方程式为___。
(4)“煮沸”的目的是_____。
(5)请设计用“冷却液”制备PbCrO4的实验操作:_____[实验中须使用的试剂有:6molL﹣1的醋酸,0.5molL﹣1Pb(NO3)2溶液,pH 试纸]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为
A. 29∶8∶13 B. 22∶1∶14 C. 13∶8∶29 D. 44∶2∶28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制98 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为 ______ mL。
(2)实验时选用的仪器有(填序号)_______
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_____
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是
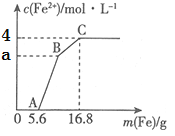
A. 原溶液的c(H+)=4mol·L—1
B. 若a=3,则原溶液中c(Cu2+)=1mol·L—1
C. 原溶液中的c(NO3-)=7mol·L-1
D. BC段发生反应的离子方程式为Cu2++Fe=Fe2++Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com