


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
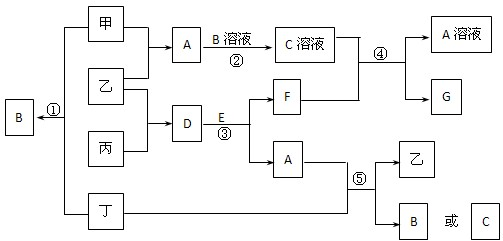
 A、B、C三种非金属元素的质子数之和为16,它们的单质在一定条件下两两化合可以生成三种常见的化合物D、E、F.D、F的一个分子中只含有10个电子,常温下D是一种液体,E是一种无色的气体.
A、B、C三种非金属元素的质子数之和为16,它们的单质在一定条件下两两化合可以生成三种常见的化合物D、E、F.D、F的一个分子中只含有10个电子,常温下D是一种液体,E是一种无色的气体.查看答案和解析>>
科目:高中化学 来源: 题型:
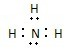
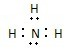
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下:

有关物质的部分物理性质如下:
|
| 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯甲醛 | —26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |
实验步骤:
(1)在250 mL锥形瓶中,放入9 g KOH和9 mL水,配成溶液,冷却至室温。加入10.5 g新蒸馏的苯甲醛,塞紧瓶塞,用力振荡,使之变成糊状物,放置24 h。
①苯甲醛要求新蒸馏的,否则会使 ▲ (填物质名称)的产量相对减少。
②用力振荡的目的是 ▲ 。
(2)分离苯甲醇
①向锥形瓶中加入30 mL水,搅拌,使之完全溶解。冷却后倒入分液漏斗中,用30 mL乙醚萃取苯甲醇(注意留好水层)。30 mL 乙醚分三次萃取的效果比一次萃取的效果 ▲ (填“好”或“差”)。
②将醚层依次用饱和亚硫酸氢钠溶液、饱和碳酸钠溶液和水各5 mL洗涤,再用无水硫酸镁干燥。将干燥后的乙醚溶液转移到100 mL蒸馏烧瓶中,投入沸石,连接好普通蒸馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代号)。
A.水浴加热 B.油浴加热 C.沙浴加热 D.用酒精灯直接加热
③改用空气冷凝管蒸馏,收集 ▲ ℃的馏分。
(3)制备苯甲酸
在乙醚萃取过的水溶液中,边搅拌边加入浓盐酸酸化至pH=3.5左右。冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省南京市四校高三12月月考化学试卷 题型:填空题
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键  D.氢键 E.配位键 F.金属键 G.极性键
D.氢键 E.配位键 F.金属键 G.极性键
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下:
有关物质的部分物理性质如下:
| | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯甲醛 | —26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |
 萃取的效果 ▲ (填“好”或“差”)。
萃取的效果 ▲ (填“好”或“差”)。 馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代
馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代 号)。
号)。 冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com