
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O= 4Fe(OH)3↓+O2↑+8Na+ 则下列说法正确的是( )
A、该反应中 Fe2+是还原剂,O2 是还原产物
B、4molNa2O2 在反应中共得到 8NA 的电子
C、Fe(OH)3 既是氧化产物又是还原产物,每生成 4mol Fe(OH)3 反应过程中共转移电子 6mol
D、反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图:

(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性 B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450ml
l60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,
所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3) 吸收塔内的温度不能超过20℃,其主要目的是 _,吸收塔内发生反应的化学方程式为 。
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)
A.蒸馏 B.蒸发浓缩 C.灼烧 D.过滤 E、冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
把一定量的Na2O2和NaHCO3的混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标况);再将此气体通入另一份混合物中,恰好完全反应后,得到O2 2.016L(标况),则加入稀盐酸的物质的量浓度是
A.3.4mol/L B.0.2mol/L C.1.8mol/L D.3.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的保存方法正确的是
①少量金属钠保存在冷水中②浓硝酸盛放在无色试剂瓶中
③少量金属钾保存在煤油中④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中
⑤氯水存放在带玻璃塞的无色细口瓶中⑥碳酸钠固体保存在带橡胶塞的细口瓶中
A.②③④ B.③④⑥ C.③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸
C.加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝
D.高温下,用金属钠与氯化钾可以置换出金属钾,说明钠的金属性比钾强
查看答案和解析>>
科目:高中化学 来源: 题型:
很多微粒具有六元环的结构。
Ⅰ.六氯环三磷腈分子中包含一个六元环,是橡胶生产中的重要中间体,其结构如图所示,其熔点为113℃,在减压下,50℃即可升华。在有机溶剂中,六氯环三磷腈可由五氯化磷与氯化铵反应制得,反应的方程式为3PCl5+3NH4Cl====P3N3Cl6+12HCl。
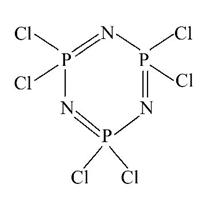
(1)比较磷元素和氯元素的第一电离能:P______Cl(填“>”或“<”)。
(2)在上述反应中断裂的化学键有________(填序号)。
A.离子键 B.配位键 C.极性键 D.非极性键
(3)P3N3Cl6的晶体类型为___________。
Ⅱ.1,3-戊二酮通过两步变化,也可以形成六元环,增加了分子的稳定性,其变化如图所示:
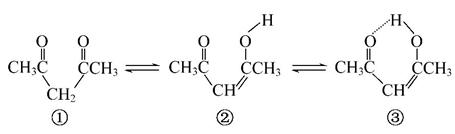
(4)由①转化为②时,π键数目________(填“增加”“减小”或“不变”)。
(5)由②转化为③时,③比②多增加了一种微粒间作用力,该作用力是__________。
Ⅲ.S和Ge可构成[Ge4S10]4-,锗和硫原子也连结成六边形结构,如图所示。
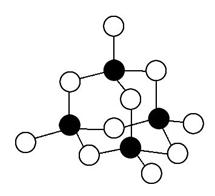
(6)锗原子的价电子排布式为_______。
(7)图中涂黑的微粒代表__________元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,pH=9的NaOH溶液和CH3COONa溶液中,假设由水电离产生的OH-浓度分别为a和b,则a与b的关系为( )
A.a>b B.a=10-4b C.b=10-4a D.a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较____________(填溶质的化学式)溶液中NH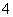 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)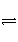
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10 mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为____________(填序号),此时溶液②中Cl-物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下 列盛放试剂的方法正确的是( )
列盛放试剂的方法正确的是( )
A.氢氟酸或浓硝酸存放在带橡皮塞的棕色玻璃瓶中
B.汽油或煤油存放在带橡皮塞的棕色玻璃瓶中
C.碳酸钠溶液或氢氧化钙溶液存放在配有磨口塞的棕色玻璃瓶中
D.氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com