
Ksp(AgCl)=1.56×10﹣10,Ksp(AgBr)=7.7×10﹣13,Ksp(Ag2CrO4)=9.0×10﹣12.某溶液中含有Cl﹣、Br﹣和CrO42﹣浓度均为0.010mol·L﹣1,向该溶液中逐滴加入0.010mol·L﹣1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为:
A.Cl﹣、Br﹣、CrO42﹣ B.CrO42﹣、Br﹣、Cl﹣ C.Br﹣、Cl﹣、CrO42﹣ D.Br﹣、CrO42﹣、Cl﹣
科目:高中化学 来源:2016-2017学年湖北省高一12月月考化学试卷(解析版) 题型:实验题
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
实验:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5(酸性环境)),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示实验中溶液变红的原因: 、 。
(2)甲探究实验中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
① 实验I说明 ;②实验III说明 。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二12月月考化学试卷(解析版) 题型:选择题
如图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1CH3COOH溶液过程中溶液pH的变化曲线。AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
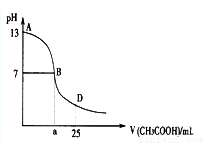
A.c(OH-)一定 大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)大于、小于或等于c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上期中化学试卷(解析版) 题型:选择题
在一定条件下,某固态化合物X受热分解的反应为:X A↑+B↑+2C↑,测得反应后生成的混合气体的密度是同温同压下H2密度的12倍,则X的摩尔质量是( )
A↑+B↑+2C↑,测得反应后生成的混合气体的密度是同温同压下H2密度的12倍,则X的摩尔质量是( )
A.24g/mol B.50g/mol C.80g/mol D.96g/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上期末化学试卷(解析版) 题型:实验题
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
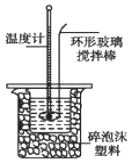
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol): 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差 ,产生偏差的原因可能是: (填字母)。
,产生偏差的原因可能是: (填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上期末化学试卷(解析版) 题型:选择题
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol· | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增 大
大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨北京实验中学高二上期末化学卷(解析版) 题型:填空题
在2L容积不变的密闭容器内,800℃时反应2N O(g)+O2(g)
O(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
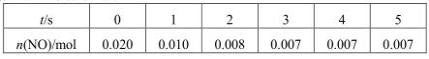
(1)用O2的反应速率表示0~2s内该反应的平均反应速率v=_______________。若上述反应在850℃下进行,反应2s时n(NO)=0.009mol,并且不再随时间而改变,则该反应是__________热反应。
(2)图中表示NO2浓度变化的曲线是__________(填字母)。
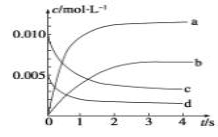
(3)能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内的压强保持不变
C.v逆(NO)=2v正(O2) D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________(填序号)。
A.及时分离出NO2 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二12月月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.一定温度下,反应MgCl2(l) = Mg(l)+ Cl2(g)的ΔH<0,ΔS<0
B.Na与H2O的反应是熵增的放热反应,该反应能自发进行
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.向0.01 mol/L KMnO4溶液中加入等浓度等体积的草酸溶液,溶液立即褪色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西安一中高二上月考二化学卷(解析版) 题型:选择题
下列说法正确的是
A.难溶电解质的溶度积Ksp越小,则它的溶解度越小
B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示
C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com