
| A. | ①②③④ | B. | ①③②④ | C. | ③①④② | D. | ④②①③ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 2.4 g 金属镁变成镁离子时失去的电子数为 0.2 NA | |
| B. | 标准状况下,18 g H2O中含有NA个水分子 | |
| C. | 常温常压下,11.2 L H2和O2的混合物所含分子个数是 0.5 NA | |
| D. | 1 mol/L NaOH溶液中含有的Na+数目是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
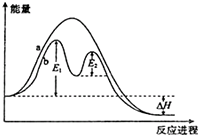
| A. | 反应过程a有催化剂参与 | |
| B. | 改变催化剂,可改变该反应的活化能 | |
| C. | 该反应为吸热反应,热效应等于△H | |
| D. | 加入催化剂,可以提升反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为($\frac{7}{22.4}$)NA | |
| B. | 1mol羟基(-OH)所含的电子总数为10NA | |
| C. | 硝化甘油、火棉、TNT都是硝酸酯 | |
| D. | 1mol碳正离子(CH3+)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数 | B. | 体积 | C. | 质量 | D. | 物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NH3溶解度比I2的溶解度大 | NH3是极性分子,I2是非极性分子 |
| B | 通常条件下,HCl比HI稳定性高 | 非金属性:Cl>I |
| C | NH2OH中N的化合价为:-3 | 电负性:Cl>N |
| D | 沸点:SiO2>CO2 | 式量:SiO2>CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往95%酒精中加入无水氯化钙,蒸馏得到无水乙醇 | |
| B. | 往2mL 10% CuSO4 溶液中滴加几滴2% NaOH,然后滴加少量乙醛,加热制得砖红色沉淀Cu2O | |
| C. | 用氯气和乙烷按1:1体积比混合,光照条件下,制纯一氯乙烷 | |
| D. | 往装有电石的烧瓶中逐滴滴加饱和食盐水,制粗乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大SO2的转化率K值一定增大 | B. | 减小压强K值减小 | ||
| C. | K值越大SO2转化率越大 | D. | 升高温度K值增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com