
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业。回答下列问题:
(1)元素电负性:D____E (填>、<或=)
(2)A、C单质熔点A_____C(填>、<或=)
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_______
 (4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为_______
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为_______
(5)氢化物的沸点:B比D高的原因______;
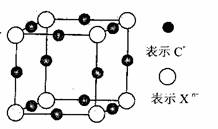
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。
该晶体中阳离子和阴离子个数比为_______,晶体中每个Xn-被_____个等距离的C+离子包围。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (2009?深圳二模)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
(2009?深圳二模)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=)
(2)A、C单质熔点A_____C(填>、<或=)
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_______
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为_______
(5)氢化物的沸点:B比D高的原因______;
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。

该晶体中阳离子和阴离子个数比为_______,晶体中每个Xn-被_____个等距离的C+离子包围。
查看答案和解析>>
科目:高中化学 来源: 题型:
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=)
(2)A、C单质熔点A_____C(填>、<或=)
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_______
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为_______
(5)氢化物的沸点:B比D高的原因______;
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。
该晶体中阳离子和阴离子个数比为_______,晶体中每个Xn-被_____个等距离的C+离子包围。
查看答案和解析>>
科目:高中化学 来源:2011届江西省六校高三联考(理综)化学部分 题型:填空题
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=)
(2)A、C单质熔点A_____C(填>、<或=)
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_______
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为_______
(5)氢化物的沸点:B比D高的原因______;
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。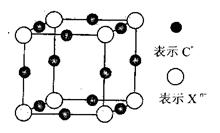
该晶体中阳离子和阴离子个数比为_______,晶体中每个Xn-被_____个等距离的C+离子包围。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com