
| A、1s22s22p63s23p63d104s24p64d15s2 |
| B、1s22s22p63s23p63d104s24p65s25p1 |
| C、1s22s22p63s23p63d104s24p64f15s2 |
| D、1s22s22p63s23p63d104s24p65s25d1 |
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,与其结构相似的化合物是
,与其结构相似的化合物是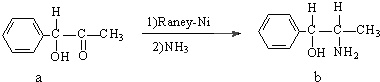
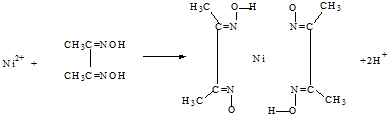
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能层序数越大,S的轨道的半径越大 |
| B、电子的运动和行星相似,围绕的原子核在固定的轨道上高速旋转 |
| C、能量低的电子只能在S轨道上运动,能量高的电子总在f轨道上运动 |
| D、同一元素的原子中,在同一能级上运动的电子,其运动状态相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
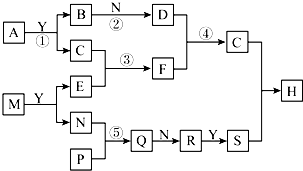 由化合物A、M开始,可发生如图所示的变化.已知A由两种元素组成,且两元素的质量比为1:3,B、P、Y都是由短周期元素形成的简单氢化物,常温下Y为无色液体,B、P均为可燃性气体,M也是由两种短周期元素组成化合物,且M的焰色反应为黄色,C是一种不溶于水的白色固体,Q属于酸性氧化物.(框图中生成的水均已略去)
由化合物A、M开始,可发生如图所示的变化.已知A由两种元素组成,且两元素的质量比为1:3,B、P、Y都是由短周期元素形成的简单氢化物,常温下Y为无色液体,B、P均为可燃性气体,M也是由两种短周期元素组成化合物,且M的焰色反应为黄色,C是一种不溶于水的白色固体,Q属于酸性氧化物.(框图中生成的水均已略去)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加CaCO3固体 |
| B、加NaOH固体 |
| C、加水 |
| D、通入NH3气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com