
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(如图甲)在煤矿巷道中的甲烷浓度达到一定值时,其传感器就可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是

A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为CH4+4O2--8e- CO2+2H2O
CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源:2017届江西省高三上学期第二次段考化学试卷(解析版) 题型:选择题
M、Q、R、V为分别占有前3周期的元素,其原子序数依次增加,M和R、Q和V属于同一主族,且它们的最外层电子数之和为14。下列说法中正确的是( )
A.单质的沸点:M>Q
B.Q元素的阴离子和V元素的阴离子都只有还原性[
C.M 、Q、R、V
、Q、R、V 四种元素组成的化合物的水溶液可以是
四种元素组成的化合物的水溶液可以是 碱
碱 性、中性和酸性
性、中性和酸性
D.Q与R可以组成2种离子化合物
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
短周期元素A、B、C的原子序数之和为37,A、B在同一周期,A+、C-具有相同的核外电子层结构。下列推测不正确的是( )
A. 同周期元素中C的氢化物稳定性最强
B. 同周期元素中A的金属性最强
C. 原子半径:A>B,离子半径:A+>C-
D. A、B、C的简单离子中,会破坏水的电离平衡的是C
查看答案和解析>>
科目:高中化学 来源:2017届四川省校高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列对如图两烧杯溶液分析一定正确的是
A.甲、乙两烧杯中水电离出的H+浓度:甲<乙
B.分别稀释相同倍数,溶液pH变化:甲=乙
C.相同条件下,AgCl(s)在甲中溶解度大于在乙中
D.向甲烧杯加入NaOH使溶液中性后一定存在:c(Na+)= c(CH3COO-)+ c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2017届湖南省实验班高三上第一次质检化学试卷(解析版) 题型:实验题
ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。


图1 图2
(1)A装置电动搅拌棒的作用是 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。
已知Ⅰ.NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;
Ⅱ.NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④ ;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)。
①制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②滴定过程中进行三次平行测定的原因是 。
③原ClO2溶液的浓度为 g·L-1(用含字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。(填“偏高”、“偏低”或“不变” )
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:填空题
[选修3:物质结构与性质]
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有____________种;写出Cu+的核外电子排布式____________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有_________种,属于d区的元素有____________种。
(3)CaO晶胞如下图所示,CaO晶体中Ca2+的配位数为____________;
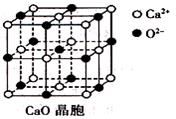
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小 |
B.晶体钾的晶胞结构如图所示: |
C.氮的第一电离能大于氧 |
D.氮气常温下很稳定,是因为氮的电负性小 |
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为___________,CNO-的中心原子的杂化方式为___________。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+。
将含0.0015mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述不正确的是( )
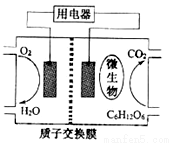
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C.放电过程中,质子(H+)从负极区向正极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标
准状况下CO2气体22.4 L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:填空题
在一密闭容器中,充入1mol N2 和3 mol H2,并在一定温度和压强条件下,使其发生反应:N2(g) + 3H2 (g) 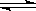 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
(1)若保持容器体积不变,再向其中充入1mol N2,反应速率会_________(填“加快”、“减慢”或“不变”),理由是______________________。
(2)若保持容器体积不变,再向其中充入1mol氩气,反应速率会_________(填“加快”、“减慢”或“不变”),理由是_______________________。
(3)若保持容器气体压强不变,再向其中充入1mol N2 和3 mol H2,反应速率会_________(填“加快”、“减慢”或“不变”),理由是____________________。
(4)使用催化剂,反应速率会_________(填“加快”、“减慢”或“不变”),理由是_________________。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
如图是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( )
A. X和W位于同一主族
B. 原子半径:Y>Z>X
C. 盐YRX与化合物WX2的漂白原理相同
D. Y和R两者的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com