
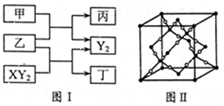
 键与π键的数目之比为_________;
键与π键的数目之比为_________;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
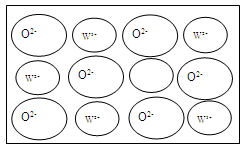
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A | A的最高价氧化物对应的水化物化学式为H2AO3 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | Z的基态原子最外层电子排布式为3s23p2 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X的单质固态时为分子晶体 | B.Y的单质可以形成原子晶体 |
| C.X与Y形成的化合物固态时为分子晶体 | D.X与碳形成的化合物为分子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第七周期第ⅥA族 | B.第六周期第ⅥA族 |
| C.第六周期第ⅡA族 | D.第五周期第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱金属单质在空气中燃烧的生成物都是过氧化物 |
| B.少量的碱金属单质都能保存在煤油中 |
| C.HF、HCl、HBr、HI的稳定性、还原性从左到右依次减弱 |
| D.随着原子序数的递增,卤素单质的颜色由浅到深,熔沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
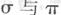 键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。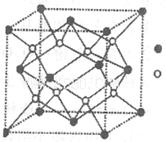
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com