
C��N��O��Al��Si��Cu�dz���������Ԫ�ء�
��1��Siλ��Ԫ�����ڱ���____���ڵ�_____�塣
��2��N�Ļ�̬ԭ�Ӻ�������Ų�ʽΪ_____��Cu�Ļ�̬ԭ���������___�����ӡ�
��3���á�>����<����գ�
| ԭ�Ӱ뾶 | �縺�� | �۵� | �е� |
| Al_____Si | N____O | ���ʯ_____����� | CH4____SiH4 |
��4�������£�����ȥ��������Ĥ��Al��CuƬ����ŨHNO3�����ԭ��أ�ͼ1�������ԭ��صĵ���ǿ�ȣ�I����ʱ�䣨t���ı仯��ͼ2��ʾ����Ӧ�������к���ɫ���������

0-t1ʱ��ԭ��صĸ�����AlƬ����ʱ�������ĵ缫��Ӧʽ��_____,��Һ�е�H+��___���ƶ���t1ʱ��ԭ����е��������������ı䣬��ԭ����______��
���𰸡���1���� IVA ����2��1s22s22p3��1����3��>��<��>��<��4��2H+ + NO3-+e-=NO2 ��+ H2O������Al��Ũ�����з����ۻ�������Ĥ��ֹ��Al��һ����Ӧ
 �����㶨λ����������ʵ���⣬����֪ʶ�㸲�Ƿ�Χ�Ϲ㣬����Ԫ�����ڱ���Ԫ�������ɡ���������Ų����������͡�ԭ���ԭ����֪ʶ���Ѷ�Ҳ�ɼ����ѡ�
�����㶨λ����������ʵ���⣬����֪ʶ�㸲�Ƿ�Χ�Ϲ㣬����Ԫ�����ڱ���Ԫ�������ɡ���������Ų����������͡�ԭ���ԭ����֪ʶ���Ѷ�Ҳ�ɼ����ѡ�
����ʦ�㾦 ������Ԫ�����ڱ������չؼ��ǹ淶����Ԫ�������ڱ��е�λ�ã����ں���ı�ʾ��дҪ�淶������д�����Ų�ʽʱҪע������������ԭ��������������ԭ����ͬʱ��Ҫע����ع����е��������������ȫ���ṹ�������ԣ��������ͺͷ��ӵĽṹ�������������ʵ�Ӱ�죬��ѧ�����������ʵ�Ӱ��Ҳ�DZ���Ŀ����ص㣻�ж�ԭ��ص��������ؼ���������ԭ��صı�����������ԭ��Ӧ���������ԭ�����ж�������������ʧ���ӣ�����������Ӧ�������ٸ��ݵ缫���ϡ��������Һ�������Ϣ��д�缫��Ӧʽ��
������Ԫ�����ڱ������չؼ��ǹ淶����Ԫ�������ڱ��е�λ�ã����ں���ı�ʾ��дҪ�淶������д�����Ų�ʽʱҪע������������ԭ��������������ԭ����ͬʱ��Ҫע����ع����е��������������ȫ���ṹ�������ԣ��������ͺͷ��ӵĽṹ�������������ʵ�Ӱ�죬��ѧ�����������ʵ�Ӱ��Ҳ�DZ���Ŀ����ص㣻�ж�ԭ��ص��������ؼ���������ԭ��صı�����������ԭ��Ӧ���������ԭ�����ж�������������ʧ���ӣ�����������Ӧ�������ٸ��ݵ缫���ϡ��������Һ�������Ϣ��д�缫��Ӧʽ��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ʵĵ���ƽ�⡢�����ˮ��ƽ�����������ܽ�ƽ������ڻ�ѧƽ�⡣
��.��֪H2A��ˮ�д�������ƽ�⣺H2AH����HA����HA��H����A2����
(1)��ͬŨ���£�NaHA��Һ��pH________(����ڡ�����С�ڡ����ڡ�) Na2A��Һ��pH��
(2)ij�¶��£�����0.1 mol/L��NaHA��Һ����εμ�0.1 mol/L KOH��Һ����Һ�����ԡ���ʱ�û����Һ�����й�ϵ�У�һ����ȷ����________��
a��c(H��)��c(OH��)��1��10��14
b��c(Na��)��c(K��)��c(HA��)��2c(A2��)
c��c(Na��)��c(K��)
d��c(Na��)��c(K��)��0.05 mol/L
(3)��֪������H2A�ĸ���(CaA)������Һ�д�������ƽ�⣺
CaA(s)Ca2��(aq)��A2��(aq)����H��0��
�ٽ����¶�ʱ��Ksp________(�������С�����䡱)��
�ڵμ�����Ũ���ᣬc(Ca2��)________(�������С�����䡱)��
��.����Cr2O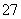 �ķ�ˮ���Խϴ�ij������ˮ�к�5.00��10��3 mol��L��1��Cr2O
�ķ�ˮ���Խϴ�ij������ˮ�к�5.00��10��3 mol��L��1��Cr2O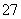 ��Ϊʹ��ˮ�ܴ���ŷţ������´�����Cr2O
��Ϊʹ��ˮ�ܴ���ŷţ������´�����Cr2O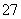
 Cr3����Fe3��ʯ��ˮ,Cr(OH)3��Fe(OH)3
Cr3����Fe3��ʯ��ˮ,Cr(OH)3��Fe(OH)3
(1)�÷�ˮ�м����̷�(FeSO4��7H2O)��ϡ���ᣬ������Ӧ�����ӷ���ʽΪ
________________________________________________________________________��
(2)��ʹ10 L�÷�ˮ�е�Cr2O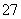 ��ȫת��ΪCr3������������Ҫ����________g FeSO4��7H2O��
��ȫת��ΪCr3������������Ҫ����________g FeSO4��7H2O��
(3)��������ķ�ˮ�в�����c(Fe3��)��2��10��13 mol��L��1���������Cr3����Ũ��Ϊ________��(��֪��
Ksp��4.0��10��38��Ksp��6.0��10��31)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ȷ��ʾ���з�Ӧ�����ӷ���ʽ�ǣ���
| A�� | ��̼��������Һ�м������HCO3��+H+=CO2��+H2O | |
| B�� | �ѽ���������ϡ�����У�2Fe+6H+=2Fe3++3H2�� | |
| C�� | ���Ȼ�������Һ��ͨ��������Fe2++Cl2=Fe3++2Cl�� | |
| D�� | �Ƹ�ˮ��Ӧ��Na+2H2O=Na++2OH��+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ��С�ձ������Լ20 g����ĥ�ɷ�ĩ�������������壬��С�ձ����������ѵ���3��4��ˮ�IJ���Ƭ�ϣ�Ȼ���ټ���Լ10 g NH4Cl���壬�������ò�����Ѹ�ٽ��衣������������⣺
(1)д���йط�Ӧ����ʽ ���÷�Ӧ���� ��Ӧ�����������Ӧ���ͣ�
(2)ʵ����Ҫ�����ò�����Ѹ�ٽ����ԭ����__ ��
(3)���ʵ����û�п���������������ܵ�ԭ����(�о�����) ��
(4)�����������˵���˸÷�Ӧ�� �ȣ���š�������������Ӧ������������������������ ����ߡ��͡�����
(5)������ʵ������У��ý���ϡ�����ʪ�����ڶ�����ϰ��ϵ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й��ڻ���Ӫ�����ʵ�˵������ȷ����
A. ���������� ������ˮ��Ϊ������ B. ������������
������ˮ��Ϊ������ B. ������������ ��
�� ����ˮ��Ϊ������
����ˮ��Ϊ������
C. ��ά��������������ˮ��Ϊ������ D. ��֬�������� ����ˮ��Ϊ���ͺ�֬����
����ˮ��Ϊ���ͺ�֬����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
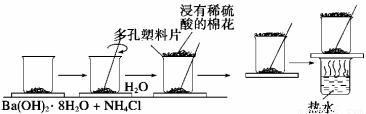
����ҽҩ�����ࡢ��Ⱦ�ϡ���������������й㷺����;����������Ȼ�����Ũ���൱С��ÿ����ˮ��ƽ������0.06 mg�������������ܴ����Ժܾ��ˡ���9.3��1010t����½����Ҫ��ö� ��һ�������ں��ĺ�������0.3%��0.5%���еĿɴ�1%���Ⱥ�ˮ�е��Ũ�ȸ߳�ʮ���������к��зḻ�ĵ�Ԫ��(��I����ʽ����)��ʵ������ȡ����������£�
��һ�������ں��ĺ�������0.3%��0.5%���еĿɴ�1%���Ⱥ�ˮ�е��Ũ�ȸ߳�ʮ���������к��зḻ�ĵ�Ԫ��(��I����ʽ����)��ʵ������ȡ����������£�
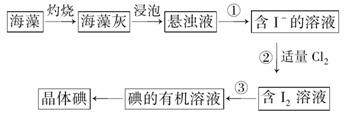
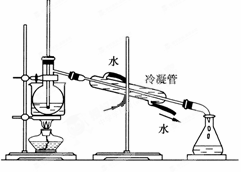
(1)�����߿��ڻ���ʵ������ٵ�����װ��ʾ��ͼ��ʵ������۵�������__________��������Ҫ��������Ϊ__________________��
 |
˵����ʵ��װ�������������淽����ʾ������̨�����ӽ��ܵȲ��ػ�����������ȣ��������·��á�������ʾ������ͼʾ��Ϊ����������Ӧ����Һ��������ӽ��档
(2)��ȡ��Ĺ����У��ɹ�ѡ����л��Լ���____________(�����)��
A���ƾ�(�е�78 ��) B �����Ȼ�̼(�е�77 ��)
�����Ȼ�̼(�е�77 ��)
C������(�е�290 ��) D����(�е�80 ��)
(3)�ڲ������У���Һ����������ICl��Ϊ���Ĵ����ʣ�ʹ��ȫ�����������Ӧ��������________(�����)��Һ����Ӧ�����ӷ���ʽΪ____________��
A��KIO3 B��HClO C��KI D��Br2
(4)Ϊʹ�Ӻ����л���Һ����ȡ�Ⲣ�����ܼ��� ����ˮԡ��������(��ͼ��ʾ)����ָ��ͼ��ʵ��װ���д���֮��(�д���������пհɲ�������Ҳ�ɲ���)��
����ˮԡ��������(��ͼ��ʾ)����ָ��ͼ��ʵ��װ���д���֮��(�д���������пհɲ�������Ҳ�ɲ���)��
��______ ��
��__ ��
��___________ __ ��
__ ��
��_________________ ��
(5)ʵ����ʹ��ˮԡ��ԭ����____________��������ۼ���_____(����������)�С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���л���ķ�����Ϊ70,������ױ�����̼̼˫����C��O�Ĵ��ڣ��˴Ź�����������ͼ��
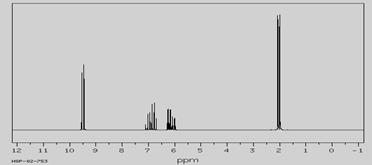 |
�����˴Ź�������ͼ���ش��������⣺
�����й��� �ֻ�ѧ������ͬ����ԭ�ӣ�д�������ʵķ���ʽ
д�����л���Ŀ��ܵĽṹ��ʽ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com