
分析 X、Y、Z、W、L为五种短周期元素,非金属元素X最外层电子数与其周期序数相同,则X为H,Y的最外层电子数是其所在周期数的2倍,则Y为C或S,Y在Z中充分燃烧能生成其最高价化合物YZ2,则Y应为C,Z为O,W+与Z2-具有相同的电子数,则W为Na,X在L中燃烧,产物XL溶于水得到一种强酸,则L为Cl,据此答题.
解答 解:X、Y、Z、W、L为五种短周期元素,非金属元素X最外层电子数与其周期序数相同,则X为H,Y的最外层电子数是其所在周期数的2倍,则Y为C或S,Y在Z中充分燃烧能生成其最高价化合物YZ2,则Y应为C,Z为O,W+与Z2-具有相同的电子数,则W为Na,X在L中燃烧,产物XL溶于水得到一种强酸,则L为Cl,
(1)X为H,X在周期表中的位置是第一周期IA族,实验室制备单质Cl2的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,Cl2尾气用氢氧化钠吸收处理,其离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:第一周期IA族;MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O;
(2)由X分别与Y、Z形成的最简单化合物为CH4、H2O,元素的非金属性越强,对应的氢化物的稳定性也越强,由于氧的非金属性强于碳,所以CH4、H2O的稳定性关系为:H2O>CH4,
故答案为:H2O>CH4;
(3)由X、Y、Z、W组成的一种盐,在面食中有大量使用,应为NaHCO3,其俗名为小苏打,由X、Y、Z形成的日常生活中常见的一种酸为 H2C2O4,NaHCO3与H2C2O4反应的离子方程式为H2C2O4+2HCO3-=C2O42-+2CO2+H2O,
故答案为:小苏打;H2C2O4+2HCO3-=C2O42-+2CO2+H2O.
点评 本题考查元素化合物推断,题目涉及的知识点较多,侧重于考查学生对所学知识点综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 同样多 | B. | HCl最多 | C. | HCl、HNO3一样多 | D. | CH3COOH最少 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
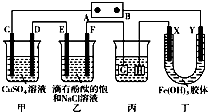 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答下列问题:
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol羟基与17g NH3所含电子数都为10NA | |
| B. | 1molCl2溶于水的过程中有NA个电子转移 | |
| C. | 1molC(金刚石)中σ 键的数目为2NA | |
| D. | 适量铜粉溶解于1L 0.5 mol/L稀硝酸中,当生成2.24L NO时,溶液中氮原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃、101kPa下,1 g氢气燃烧生成液态水放出142.9 kJ热量,其热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ•mol-1 | |
| B. | 由水电离出的c(H+)=1×10-13mol/L的溶液中,CO32-、K+、SO42-、Cl-在溶液中可能大量存在 | |
| C. | 浓度均为0.lmol•L-1Na2CO3和NaHCO3混合液中:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有14mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
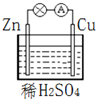
| A. | 该装置能将电能转化为化学能 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 负极反应为 Zn-2e-═Zn2+ | D. | Cu为正极材料,正极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
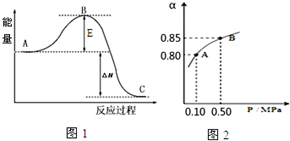 向某10L的恒温密闭容器中充入2molSO2和1molO2,2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3放热99kJ,请回答:
向某10L的恒温密闭容器中充入2molSO2和1molO2,2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3放热99kJ,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na 与 Cl2反应能形成离子键,故 K与 Cl2反应也能形成离子键 | |
| B. | Cl2 能置换出 NaBr溶液中的溴,故I2也能置换出NaBr溶液中的溴 | |
| C. | Li在氧气中燃烧生成 Li2O,故Na在氧气中燃烧也生成Na20 | |
| D. | C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO 16.0g | B. | Cu(OH)2 19.6g | C. | Cu 12.8g | D. | CuCO3 24.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com