
分析 实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子;
实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,根据亚硫酸钠和转移电子的关系式计算转移电子的物质的量;
根据同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性判断ClO-、I2、SO42-的氧化性强弱.
解答 解:(1)实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子,该反应中,次氯酸根离子得电子作氧化剂,碘离子失电子是还原剂,氧化产物是碘,所以氧化性强弱为:ClO->I2,反应离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,
故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;
(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,氧化剂是碘,还原剂是亚硫酸钠,氧化产物是硫酸根离子,所以氧化性强弱为:I2>SO42-,反应离子方程式为:H2O+I2+SO32-=SO42-+2I-+2H+,
设转移电子的物质的量为x.
H2O+SO32-+I2=SO42-+2I-+2H+转移电子
1mol 2mol
0.5mol/L×0.004L x
x=$\frac{0.5mol/L×0.004L×2mol}{1mol}$=0.004mol,
故答案为:0.004 mol;
(3)实验①说明氧化性强弱为:ClO->I2,实验②说明氧化性强弱为:I2>SO42-,所以在酸性条件下ClO-、I2、SO42-的氧化性由强到弱的顺序是ClO-、I2、SO42-;
故答案为:ClO-、I2、SO42-.
点评 本题以实验设计为载体考查了物质氧化性强弱的判断,明确“同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性”是解本题的关键,难度不大,侧重于考查学生的分析能力和实验探究能力.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:实验题
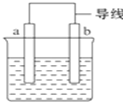 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| D | 测定等浓度的HCl、HNO3两溶液的pH | 比较Cl、N的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 ;⑦
;⑦ 和
和 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的电子排布图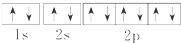 | B. | Na+的结构示意图: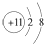 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化的电子排布式:[Na]3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| W | 短周期内原子半径最大的元素 |
| N | 原子序数比T小,且与T在同一主族 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氨化物的水溶液呈碱性 |
| Z | 元素最高正价为+7价 |
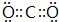 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式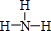 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com