
| V |
| Vm |
| m |
| ρ |
| n |
| V |
| 2.24L |
| 22.4L/mol |
| 1000g+36.5g |
| 1020g/L |
| 1036.5 |
| 1020 |
| 0.1mol | ||
|


科目:高中化学 来源: 题型:
| A、水加热到很高温度都难以分解 |
| B、水结成冰体积膨胀,密度变小 |
| C、CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D、NH3的热稳定性比PH3强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用蔗糖做食品的甜味剂 |
| B、用甲醛侵泡水产品 |
| C、用干冰保存易腐败的食品 |
| D、用袋装生石灰做饼干类食品的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
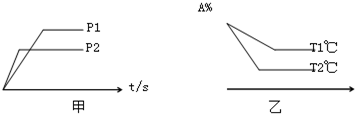
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
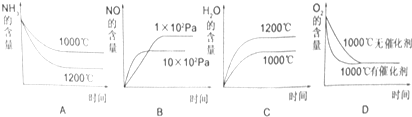
| 时间/浓度(mol/L) | C(NH3) | C(O2) | C(NO) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com