


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
| A、HCHO分子中既含σ键又含π键 |
| B、CO2分子中的化学键为非极性键 |
| C、NH3分子中N原子的杂化轨道类型是sp2 |
| D、沸点:HF>NH3>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、85.5% |
| B、66.7% |
| C、33.3% |
| D、27.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.下列有关仪器的使用,能实现的是
Ⅰ.下列有关仪器的使用,能实现的是查看答案和解析>>
科目:高中化学 来源: 题型:
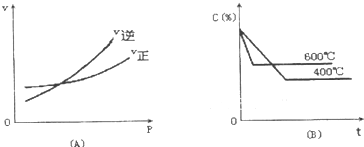 如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-808.7Kj/mol |
| B、N2O3(g)?NO2(g)+NO(g)△H=+41.8Kj/mol |
| C、3NO2(g)+H2O(l)?2HNO2(l)+NO(g)△H=-261.3Kj/mol |
| D、CO2(g)+C(s)?2CO(g)△H=+171.4Kj/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L SO3中所含有的原子数2NA |
| B、实验室中用4mol HCl的浓盐酸跟足量MnO2 加热反应可制得的Cl2分子数为NA |
| C、25℃时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA |
| D、2.3g钠与一定量的氧气完全反应,转移的电子数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成.据此判断下列说法中不正确的是( )
如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成.据此判断下列说法中不正确的是( )| A、上述反应是置换反应 |
| B、上述反应说明钠比铜活泼 |
| C、上述反应证明钠可以从CuSO4溶液中置换出铜 |
| D、加热且无水条件下,Na可以与CuSO4反应并生成Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大FeO(s)表面积 |
| B、增大体系压强 |
| C、升高体系温度 |
| D、使用适合的催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com