
| A. | 醋酸和足量的氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 溴化亚铁溶液中通入足量的氯气:2 Fe2++4 Br-+3 Cl2═2 Fe3++2 Br2+6 Cl- | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 碳酸氢铵稀溶液中加入过量的石灰水:Ca2++HCO3-+2 OH-+NH4+═CaCO3↓+NH3•H2O+H2O |
分析 A.醋酸为弱酸应保留化学式;
B.氯气足量,二价铁离子、溴离子都被氧化;
C.碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
D.氢氧化钙过量,反应生成碳酸钙、一水合氨和水.
解答 解:A.醋酸和足量的氢氧化钠溶液反应,离子方程式:CH3COOH+OH-═H2O+CH3COO-,故A错误;
B.溴化亚铁溶液中通入足量的氯气,离子方程式:2 Fe2++4 Br-+3 Cl2═2 Fe3++2 Br2+6 Cl-,故B正确;
C.用小苏打治疗胃酸过多,离子方程式:HCO3-+H+═CO2↑+H2O,故C正确;
D.碳酸氢铵稀溶液中加入过量的石灰水,离子方程式:Ca2++HCO3-+2 OH-+NH4+═CaCO3↓+NH3•H2O+H2O,故D正确;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,选项B为易错选项.


科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂,金属单质一定是还原剂 | |
| C. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热测定实验时,如果没有环形玻璃搅拌棒,可用环形铜质搅拌棒代替 | |
| B. | 用pH试纸测定溶液的pH值时,先把试纸放在待测液中,然后比色 | |
| C. | 含NO2球放在热水中的平衡球颜色加深,放入冷水中的平衡球颜色变浅 | |
| D. | 向盛有FeCl3溶液的试管中加入KSCN溶液,立即生成血红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,I的化学式Mg(OH)2;
,I的化学式Mg(OH)2;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
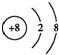 ;A、F两元素组成的化合物电子式为Na+[:H]-.
;A、F两元素组成的化合物电子式为Na+[:H]-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常情况下,甲烷跟强酸、强碱、强氧化剂都不反应 | |
| B. | 甲烷的化学性质比较稳定,点燃前不必验纯 | |
| C. | 甲烷与氯气反应,无论生成CH3Cl、CH2Cl2、CHCl3、CCl4,都属于取代反应 | |
| D. | 甲烷的四种有机氯代产物都难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
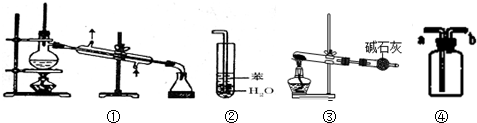
| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收氨气,防止倒吸 | |
| C. | 以KClO3 为原料,装置③可用于制备少量O2 | |
| D. | 装置④a进口可收集H2、CO 等气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com