
【题目】过氧化钙(CaO2)在室温下稳定,加热至350℃左右,迅速分解。微溶于水,不溶于乙醇,可溶于稀酸生成过氧化氢。实验室用如下方法制备CaO2并测定其纯度。过氧化钙的制备实验装置和步骤如下:
将盛有H2O2溶液和氨水混合液的三颈烧瓶置于冷水浴中,在搅拌下滴入CaCl2溶液,析出固体CaO2·8H2O。对所得固体过滤,用5mL无水乙醇洗涤2![]() 3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
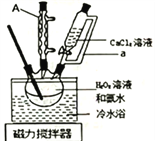
(1)仪器A的名称为:_____________________;恒压分液漏斗的导管a的作用为_________________。
(2)三颈烧瓶中发生反应的化学方程式为___________________________;将三颈烧瓶置于冷水浴中,其主要目的为________________________________。
(3)用无水乙醇代替水洗涤的目的是:___________________________;判断脱水干燥是否完全,需要至少冷却后称重____________次。
(4)过氧化钙纯度的测定,装置如下图所示:
检查装置气密性后,精确称取m g过氧化钙样品加入试管中,调整甲管内液面读数在0-1mL之间,并与乙管的液面相平,记下甲管内液面的初读数V1mL。加热,过氧化钙逐渐分解放出氧气,完全分解,停止加热冷却至室温后,使甲乙两管的液面相平,记下甲管内液面的终读数V2mL,设在此温度和压强下气体摩尔体积为VmL·mol-1,则样品中CaO2的质量分数为___________%。
(5)过氧化钙用于长途运输鱼苗,可能的原因是____________________________________。
【答案】 球形冷凝管 使恒压分液漏斗上部与三颈烧瓶相通,便于漏斗内液体顺利流下 CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl (反应放热)防止双氧水分解和氨水挥发 降低洗涤过程中固体物质的溶解损失,乙醇易挥发,更利于干燥 2 ![]() 可与水缓慢反应放出氧气作供氧剂,可杀菌消毒,可吸收CO2等(合理即得分)
可与水缓慢反应放出氧气作供氧剂,可杀菌消毒,可吸收CO2等(合理即得分)
【解析】(1)仪器A的名称为:球形冷凝管;恒压分液漏斗可以起到平衡压强的作用,因此,恒压分液漏斗的导管a的作用为使上部与三颈烧瓶相通,便于漏斗内液体顺利流下。
(2)从题干叙述可知,CaCl2和H2O2溶液和氨水混合液反应生成CaO2·8H2O↓,化学方程式为CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl;由于该反应放热,且双氧水易分解,氨水易挥发,故需要冷水浴,因此本题正确答案为:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl ;(反应放热)防止双氧水分解和氨水挥发。
(3)由信息知过氧化钙(CaO2)微溶于水,不溶于乙醇,用无水乙醇代替水洗涤可降低洗涤过程中固体物质的溶解损失,乙醇易挥发,更利于干燥;判断脱水干燥是否完全,需要至少冷却后称重2次,两次结果相差不超过0.1g。因此本题答案为:降低洗涤过程中固体物质的溶解损失,乙醇易挥发,更利于干燥;2。
(4)根据反应方程式:2CaO2===2CaO+O2↑,生成O2的物质的量=![]() mol,CaO2的物质的量=2
mol,CaO2的物质的量=2![]() mol,则样品中CaO2的质量分数=
mol,则样品中CaO2的质量分数=![]() %。本题答案为:
%。本题答案为:![]() 。
。
(5)结合题给信息,过氧化钙用于长途运输鱼苗,可能的原因是可与水缓慢反应放出氧气作供氧剂,可杀菌消毒,可吸收CO2等。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】能在无色溶液中大量共存的一组离子是( )
A.NH4+、SO42-、OH-、K+B.Fe3+、NO3-、Cl-、H+
C.K+、HCO3-、Cl-、H+D.H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )

A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(S)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=______,该条件下的平衡常数K=_______________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
(3)工业上可以用氨水除去反应C(s)+2NO(g)![]() N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O
N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5, H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5, H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 互为同分异构体,下列说法不正确的是
互为同分异构体,下列说法不正确的是
A. z的二氯代物有三种
B. x、y的一氯代物均只有三种
C. x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
D. x、y、z中只有x的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子结构和元素周期律表述正确的是
A. ⅦA族元素是同周期中非金属性最强的元素
B. 原子序数为15的元素的最高化合价为+3
C. 原子序数为12的元素位于元素周期表的第三周期ⅡA族
D. 第二周期ⅣA族元素的原子核电荷数和中子数一定为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示:

将 D 溶液滴入沸水中可得到以 F 为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体 F 微粒直径大小的范围:_____。
(2)A、B、H 的化学式:A_____、B_____、H_____。
(3)①写出 C 的酸性溶液与双氧水反应的离子方程式:_____。
②写出鉴定 D 中阳离子的实验方法和现象:_____。
③在 C 溶液中加入与 C 等物质的量的 Na2O2,恰好使 C 转化为 F,同时产生一种可使带火星木条复 燃的气体,写出该反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族)____________________。
(2)8个元素的最高价氧化物的水化物中,酸性最强的是___________________(填化学式)。
(3)①元素和⑥元素形成化合物的电子式是 ___________________________ 。
(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:_______________________________________________ 。
(5)下列叙述正确的是______________(填字母)。
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com