
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A.标准状况下,22.4 L氯气通入1 L水中转移的电子数为NA
B.标准状况下,11.2 L SO3所含的原子数为2NA
C.1 mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
D.15.6 g Na2S和Na2O2的混合物中含有的阴离子数等于0.2NA
【答案】D
【解析】
A.标况下22.4L氯气的物质的量为1mol,1mol氯气溶于水,只有部分氯气与水反应生成氯化氢和次氯酸,反应转移的电子小于1mol,转移的电子数小于NA,故A错误;
B.标准状况下,三氧化硫不是气体,不能使用标况下的气体摩尔体积计算11.2L三氧化硫的物质的量,故B错误;
C.一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体,故1mol氯化铁形成的氢氧化铁胶粒的个数小于NA个,故C错误;
D.硫化钠和过氧化钠的摩尔质量都是78g/mol,15.6g硫化钠和过氧化钠的混合物的物质的量n=![]() =
=![]() =0.2mol,1mol硫化钠和过氧化钠的混合物中含有1mol硫离子和过氧根离子,0.2mol硫化钠和过氧化钠的混合物中含有0.2mol硫离子和过氧根离子,含有的阴离子数N=nNA=0.2NA,故D正确;
=0.2mol,1mol硫化钠和过氧化钠的混合物中含有1mol硫离子和过氧根离子,0.2mol硫化钠和过氧化钠的混合物中含有0.2mol硫离子和过氧根离子,含有的阴离子数N=nNA=0.2NA,故D正确;
答案选D。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.Fe(OH)3溶于氢碘酸(HI):Fe(OH)3+3H+=Fe3++3H2O
B.少量铁粉投入足量的稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
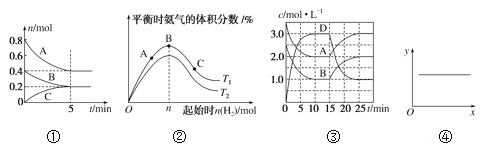
A. ①反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. ②N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
C. ③A(g)+B(g)![]() C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
D. ④2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:

(1)最适合作氧化剂X的是_________(填字母),加入X的目的是______________。
A.K2Cr2O7B.NaClO C.H2O2D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(I2+2S2O32-= S4O62-+2I-)
①可选用___________作滴定指示剂。
②CuCl2溶液与KI反应的离子方程式为________________。
③该试样中CuCl2·2H2O的质量百分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗曾做过这样一个实验:“一个抽空的密闭容器重Mg,在标准状况下,盛满相同物质的量的NO和H2的混合气体后,称量为(M+Q)g。把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的 边托盘上放置 g砝码。”横线上分别应填的是 ( )
A.右 (M+2Q)
B.右 (M+4Q)
C.左 (M+2Q)
D.左 (M+4Q)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是
A. 0.2mol·L-1Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B. 50mL 2mol·L-1的NaCl溶液和100 mL L 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C. 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol·L-1
D. 10g 98%的硫酸(密度为1.84g·cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图装置实验,若x轴表示流入正极的电子的物质的量,则y轴应表示( )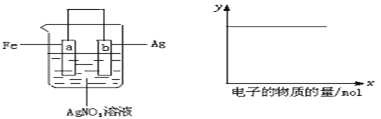
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A. ① ③ B. ③ ④ C. ① ② ④ D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电解熔融氯化钙可以得到金属钙和氯气。右图中钙及其化合物之间的转化按箭头方向均可一步实现。分析下列说法,其中正确的是
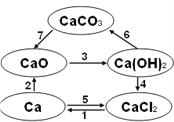
A. CaO、Ca(OH)2、CaCO3都含有氧元素,所以CaO、Ca(OH)2、CaCO3都属于氧化物
B. 电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是化合反应
C. 工业上可利用反应4的原理将氯气通入石灰乳制漂白粉,漂白粉的主要成分是CaCl2
D. 往澄清石灰水中滴加Na2CO3溶液或NaHCO3溶液都可以实现反应6的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA
B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA
C. 生成1mol还原产物时转移电子数为8NA
D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com