
【题目】根据事实,写出298K时下列反应的热化学方程式:
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为__。
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3kJ热量。___。
(3)家用液化气中主要成分之一是丁烷。当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ。试写出丁烷燃烧反应的热化学方程式___。
(4)1molHgO(s)分解为液态汞和氧气,吸热90.7kJ。__。
【答案】B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=2165kJ/mol C(s)+ H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol C4H10(g)+![]() O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol HgO(s)=Hg(l)+
O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol HgO(s)=Hg(l)+![]() O2(g) △H=+90.7kJ/mol
O2(g) △H=+90.7kJ/mol
【解析】
(1)1mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出的热量为![]() ,热化学方程式为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=2165kJ/mol,故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=2165kJ/mol;
,热化学方程式为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=2165kJ/mol,故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=2165kJ/mol;
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3kJ热量,热化学方程式为:C(s)+ H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol,故答案为:C(s)+ H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol;
(3)1g丁烷气体完全燃烧生成CO2和H2O(l),放出热量50kJ,则1mol丁烷气体完全燃烧生成CO2和H2O(l),所放出的热量为:![]() ,丁烷气体燃烧的热化学方程式为:C4H10(g)+
,丁烷气体燃烧的热化学方程式为:C4H10(g)+![]() O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol,故答案为:C4H10(g)+
O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol,故答案为:C4H10(g)+![]() O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol;
O2(g)═4CO2(g)+5H2O(l) △H=2900kJ/mol;
(4)1molHgO(s)分解为液态汞和氧气,吸热90.7kJ,热化学方程式为:HgO(s)=Hg(l)+![]() O2(g) △H=+90.7kJ/mol,故答案为:HgO(s)=Hg(l)+
O2(g) △H=+90.7kJ/mol,故答案为:HgO(s)=Hg(l)+![]() O2(g) △H=+90.7kJ/mol。
O2(g) △H=+90.7kJ/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸热反应H2S(g)+CO2(g)![]() COS(g)+H2O(g),若在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是
COS(g)+H2O(g),若在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内c(H2S):c(CO2):c(COS):c(H2O)=1:1:1:1
D.单位时间内,断开H-S键的数目和生成H-O键的数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌、鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
(1)火焰利用了部分金属元素特征的__________反应,该反应属于__________(填“物理”或“化学”)变化。
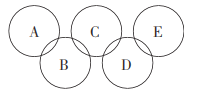
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含的电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为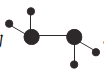 ,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,两元素的原子序数之比为2:1。根据以上信息回答下列问题:
,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,两元素的原子序数之比为2:1。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为___________________,D的化学式是___________________。
②A、B、E中均含有的一种元素为___________________(填元素名称)。
③E的电子式为___________________。
④液态B与液态E反应可生成一种气态单质和一种常见液体,1mol B参加反应放出热量Q kJ,其反应的热化学方程式为___________________。
⑤![]() 分子中的N原子有一对孤对电子,能发生反应:
分子中的N原子有一对孤对电子,能发生反应:![]() 。试写出E与足量盐酸发生反应的化学方程式:______________________________________。
。试写出E与足量盐酸发生反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如下图所示。
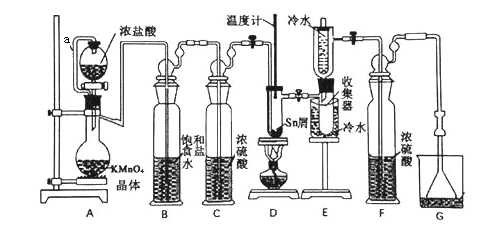
已知:①SnCl2、SnCl4有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4遇水极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是__________,装置A中发生反应的离子方程式为_____________ 。
(2)当观察到装置F液面上方出现______ 现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有两点:加快氯气与锡反应和_________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为_______________________________。
(4)Cl2和Sn的反应产物有SnCl4和SnCl2,为了防止产品中带入过多的SnCl2,装置D可改为油浴加热来控制温度,该温度范围是________。
(5)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3===SnCl4+2FeCl2,再用0.1000 mol·L—1 K2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液 20.00 mL,则SnCl4产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是烃类物质中非常重要的一类烃,应用非常广泛。请回答下列问题:
(1)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱图表明分子中含有碳碳双键,核磁共振氢谱图表明分子中只有1种类型的氢原子。
①A的结构简式为__;
②A分子中的碳原子是否处于同一平面?__(填“是”或者“不是”)
(2)烯烃与高锰酸钾酸性溶液反应的氧化产物有如下关系:
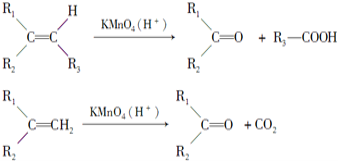
①乙烯是结构最简单的烯烃,写出实验室制取乙烯的反应方程式__,要除去混在甲烷中的乙烯,能否通过酸性高锰酸钾溶液来达到实验目的?__(填“能”或“不能”),理由是__。乙烯是一种基本的化工原料,它的产量可用来衡量一个国家石油化工发展的水平,除此之外乙烯还可用作__。
②已知某烯烃的分子式为C5H10,与高锰酸钾酸性溶液反应的氧化产物之一为CO2,则满足条件的烯烃有___种结构(用数字作答);若与高锰酸钾酸性溶液反应的氧化产物为丙酮和乙酸,则满足条件的烯烃结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH,请回答下列问题:
(1)在电解过程中,与电源正极相连的电极上发生的电极反应为__;
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有a:Na2CO3溶液,b:Ba(OH)2溶液,c:稀盐酸,其合理的加入顺序为___。
(3)如果在容积为10L的离子交换膜电解槽中,1min在阴极可产生标况下11.2L的H2,这时溶液中OH-的物质的量浓度为__;
(4)Cl2常用于自来水消毒杀菌,现有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需的Cl2和ClO2的物质的量之比为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生进行淀粉的水解实验,操作如下:
(1)取少量淀粉溶液,加入3~5滴稀硫酸,加热几分钟。淀粉水解反应的化学方程式为________________
(2)取少量冷却后的水解液,向其中加入银氨溶液,水浴加热无银镜产生。他由此认为:水解产物中没有葡萄糖。他的结论是否正确?________________,理由是________________
(3)用5t含淀粉80%的粮食,可以制得葡萄糖的质量为______。(假设淀粉的转化率为81%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol不饱和烃A可以和1molCl2发生加成反应,生成2–甲基–2,3–二氯戊烷。
(1)不饱和烃A结构简式____;
(2)满足下列条件B的结构简式和名称分别为____、____(填一种)。
①与A互为同分异构体
②能使溴水褪色
③核磁共振氢谱有五个峰,峰面积之比是3﹕3﹕3﹕2﹕1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com