
【题目】将等物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50ml溶液,然后用0.05mol/L盐酸与它反应,得到图象如下(已知:1mol=1000mmol)
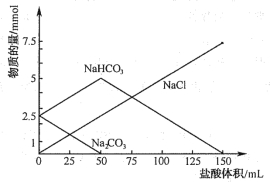
(1)盐酸加到25ml时溶液中发生反应的化学方程式 。
(2)原混合物中Na2CO3物质的量为 mol。
(3)盐酸加到150ml时,放出标准状况下气体 mL。
【答案】(1)Na2CO3+HCl=NaCl+NaHCO3 (2分);
(2)0.05(3分);(3)112(3分)。
【解析】
试题分析:(1)由图可知当盐酸加到25mL时,碳酸钠部分反应,反应的化学方程式为:Na2CO3+ HCl= NaCl+NaHCO3;(2)由图可知50ml溶液中碳酸钠完全转化为:碳酸氢钠和氯化钠,消耗盐酸的体积为:50ml,由Na2CO3+HCl=NaCl+NaHCO3可知:n(Na2CO3)=n(HCl)=0.05mol/L×0.05L=0.0025mol,所以1L溶液中碳酸钠的物质的量为n(Na2CO3)=0.0025mol×(1000÷50)=0.05mol;(3)由图50ml~150ml,发生反应为:NaHCO3+HCl=NaCl+H2O+ CO2↑,可知n(CO2)=n(HCl)=100×10-3L×0.05mol/L×22.4L/mol=0.112L=112mL。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质结构的说法正确的是
A.78 g Na2O2晶体中所含阴、阳离子个数为3NA
B.3.4 g氨气中含有0.6NA个N—H键
C.Na2O2的电子式为:![]()
D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产、生活中有极其重要的作用。
(1)我国长征系列运载火箭用肼(N2H4)作燃料。N2H4与NH3有相似的化学性质。
①写出肼与盐酸反应的离子方程式:_______________。
②在火箭推进剂中装有液态肼和双氧水,当它们混合时迅速反应生成氮气和水蒸气,写出反应的化学方程式:______________。
③火箭发射时以肼为燃料,也可以用一氧化氮作氧化剂,在此反应过程中若转移2 mol电子,则消耗燃料肼的质量为__________。
(2)汽车尾气中的氮氧化物是形成酸雨、酸雾的有毒气体之一,为了减少污染,可尝试使用汽车尾气净化装置,其原理如图所示。写出净化过程中总反应的化学方程式:_______________。
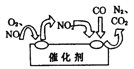
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。
(1)不能通过电解纯净的液态HF获得F2,其原因是_________________;
但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2—放电产生气体的电极反应式___________________.
(2)利用化学反应也能制取氟:K2MnF6+SbF5 → KSbF6+ MnF3+ F2↑(未配平);其中还原产物是___________.如果生成该还原产物33.6克,则反应中转移电子数目为_______________.
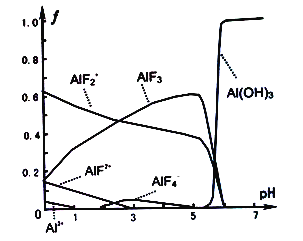
(3)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量f随PH的分布曲线如图示。用NaOH溶液使混合液的PH从5调整到7,写出有关反应的离子方程式:___________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】城市居民所用的液化石油气成分为丁烷,在使用过程中常有一些杂质以液态形式沉积于钢瓶底部,这些杂质可能是( )
A. 丙烷 B. 乙烷和丙烷 C. 乙烷和甲烷 D. 戊烷和己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第3周期元素的基态原子中,不可能出现d电子,主要依据是
A. 能量守恒原理
B. 泡利不相容原理
C. 洪特规则
D. 近似能级图中的顺序3d轨道能量比4s轨道高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液、胶体
D.工业上电解熔融的MgCl2,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有 ( )
A. 酸性 B. 碱性 C. 氧化性 D. 还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com