
| A. | 稀硫酸和碳酸钠溶液 | B. | 氯化铝溶液和氢氧化钠溶液 | ||
| C. | 稀盐酸和偏铝酸钠溶液 | D. | 碳酸钠溶液和氯化钠溶液 |
分析 不用试剂无法鉴别,则改变物质的用量,发生的反应及现象相同;结合物质的颜色及改变用量发生的反应来鉴别物质,以此来解答.
解答 解:A.将硫酸滴加到碳酸钠溶液中,先无气体生成,当滴加硫酸一定量时开始生成气体,但把碳酸钠溶液滴加到硫酸中立即生成气体,滴加顺序不同,产生的现象不同,可不用其它试剂进行鉴别,故A不选;
B.将氯化铝溶液滴加到氢氧化钠溶液中,先无沉淀生成,当氯化铝滴加到一定程度时才有沉淀,但把氢氧化钠溶液滴加到氯化铝溶液中,立即产生沉淀,当氢氧化钠过量时沉淀溶解,滴加顺序不同,反应的现象不同,用其他试剂就可鉴别,故B不选;
C.HCl少量生成沉淀,HCl过量沉淀溶解,不需要试剂可鉴别,故C不选;
D.碳酸钠溶液和氯化钠溶液不反应,不用其他任何试剂或试纸无法鉴别,故D选.
故选D.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重与量有关的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 振荡分液漏斗时应关闭其玻璃塞和活塞 | |
| B. | 滴定管装液滴定时应先用标准溶液润洗 | |
| C. | 蒸馏时温度计的水银球处于蒸馏烧瓶支管附近 | |
| D. | 锥形瓶用作反应容器时,一定不能加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、MnO4-、Na+、Cl- | B. | K+、Fe2+、NO3-、HCO3- | ||
| C. | Na+、K+、NO3-、SO42- | D. | Fe3+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{135}{53}$I是碘的一种同素异形体 | |
| B. | $\stackrel{135}{53}$I是一种新发现的元素 | |
| C. | $\stackrel{135}{53}$I位于元素周期表中第四周期ⅦA族 | |
| D. | $\stackrel{135}{53}$I核内的中子数与核外电子数之差为29 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 取用化学药品时,应特别注意观察药品包装上的安全警示标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取12.0 g胆矾溶于480m L水中 | |
| B. | 取8.0 g CuSO4溶于480m L水 | |
| C. | 取12.5 g胆矾溶于水,再转入500mL容量瓶中,加水至刻度 | |
| D. | 取12.5 g胆矾加热除去结晶水,再放入500mL容量瓶中,加水至刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
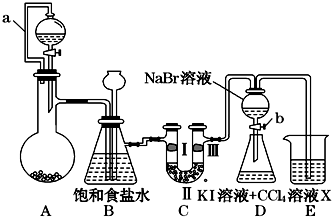 某同学设计如图所示的实验方案:
某同学设计如图所示的实验方案:| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60% | B. | 33.3% | C. | 36% | D. | 40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com