
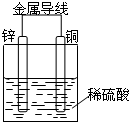
| A. | 锌为正极,发生氧化反应 | |
| B. | 铜为负极,铜片溶解 | |
| C. | 电子由铜片通过导线流向锌片 | |
| D. | 铜片上发生的电极反应:2 H++2e-=H2↑ |
分析 Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,溶液中阳离子向正极移动,阴离子向负极移动.
解答 解:A、Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,负极上失电子发生氧化反应,故A错误;
B、较不活泼的金属铜作正极,正极上氢离子得电子发生还原反应,铜片不溶解,故B错误;
C、电子从负极锌片沿导线流向正极铜片,故C错误.
D、该原电池放电时,溶液中氢离子从铜片获得电子被还原成氢原子生成氢气,2H++2e-=H2↑,故D正确.
故选D.
点评 本题考查了原电池原理,难度不大,难点是判断溶液中阴阳离子的移动方向.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.40 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5 517.6 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJ•mol-1 | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=-5 517.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A3BC4 | B. | A2(BC4)3 | C. | A2BC3 | D. | A2BC4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水混合,振荡静置,溴水层褪色 | |
| B. | 乙烯通入酸性髙锰酸钾溶液中,溶液褪色 | |
| C. | 乙烯通入溴的四氛化碳溶液中,溶液褪色 | |
| D. | 甲烷与氯气混合光照,气体颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
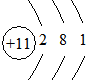 ;
; ;用电子式表示A和B元素组成的化合物的形成过程
;用电子式表示A和B元素组成的化合物的形成过程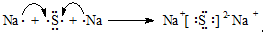 ;
;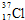 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
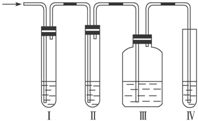 (1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)
(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光纤的主要成分是高纯度的单质硅 | |
| B. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| C. | 因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 | |
| D. | 28Si、29Si、30Si互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com