
 ,
, ;离子键、共价键
;离子键、共价键| 3 |
| ||
| 3 |
| ||
| 10-14 |
| 10-11 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| △ |
| 化学键 | H-Cl | O=O | Cl=Cl | H-O |
| 键能/kJ.mol-1 | 431 | 498 | 243 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属元素的原子最外层电子数越少,则该元素的金属性越强 |
| B、同周期元素原子半径和离子半径从左到右均依次减小 |
| C、第三周期非金属氧化物对应水化物的酸性从左到右依次增强 |
| D、第ⅦA族元素气态氢化物的还原性从上到下依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硝基苯的结构简式: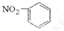 | ||
B、NH4Cl的电子式: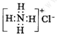 | ||
C、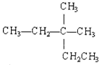 的名称为:3,3二甲基戍烷 的名称为:3,3二甲基戍烷 | ||
D、具有16个质子、16个种子和18个电子的微粒一定是
|
查看答案和解析>>
科目:高中化学 来源: 题型:
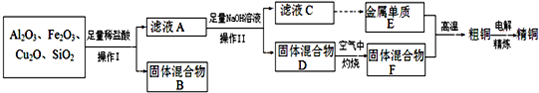
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
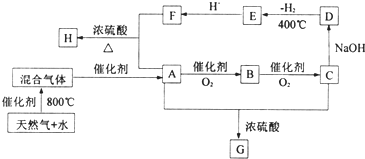
查看答案和解析>>
科目:高中化学 来源: 题型:
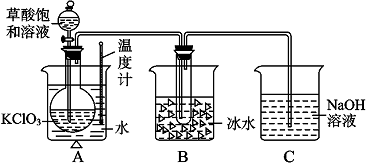
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入加入足量0.1mol?L-1 CH3COOH. | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
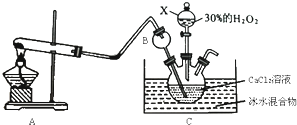
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com