
 25℃时,将氨水与氯化铵溶液混合得到c(NH3?H2O)+c(NH4+)=0.1mol?L-1的混合溶液.溶液中c(NH3?H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到c(NH3?H2O)+c(NH4+)=0.1mol?L-1的混合溶液.溶液中c(NH3?H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )| A、W点表示溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| B、pH=10.5溶液中c(Cl-)+c(OH-)+c(NH3?H2O)<0.1 mol?L-1 |
| C、pH=9.5溶液中c(NH3?H2O)>c(NH4+)>c(OH-)>c(H+) |
| D、向W点所表示1L溶液中加入0.05molNaOH固体(溶液体积变化可忽略):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子、C原子的I,能层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息回答:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子、C原子的I,能层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 、④CH3COONH4、⑤NH4HCO3
、④CH3COONH4、⑤NH4HCO3查看答案和解析>>
科目:高中化学 来源: 题型:
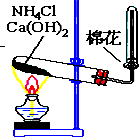 如图所示,是实验室制备某常见气体的实验装置,请填空:
如图所示,是实验室制备某常见气体的实验装置,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极100 g,阴极128 g |
| B、阳极91.0 g,阴极119.0 g |
| C、阳极93.6 g,阴极121.6 g |
| D、阳极86.0 g,阴极114.0 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离常数(25℃) |
| HF | Ki=3.6×10 -4 |
H3PO4 | Ki1=7.5×10 -3 Ki2=6.2×10 -8 Ki3=2.2×10 -13 |
| A、NaF和H3PO4反应的产物只有HF、NaH2PO4 |
| B、0.10 mol/L的溶液,pH由大到小的顺序是Na3PO4>Na2HPO4>NaF>NaH2PO4 |
| C、0.10 mol/L的H3PO4溶液中,0.30 mol/L>c(H+)>0.10 mol/L |
| D、25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向SO2水溶液中滴加Ba(NO3)2溶液,产生的白色沉淀是BaSO3 |
| B、向溴水中通入SO2,溶液褪色,说明+4价硫具有还原性 |
| C、将过量的SO2通入石蕊溶液中,溶液由紫色变为红色,说明SO2不能漂白石蕊 |
| D、向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.01×1023个SO2分子的质量为32 g |
| B、CH4的摩尔质量为16 g |
| C、1 mol H2O的质量为18 g/mol |
| D、不同的气体,若体积不等,则它们所含的分子数一定不等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com