
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | CO2有氧化性 | 点燃的Mg条能在CO2中继续燃烧 |
| B | KNO3的溶解度大 | 可用重结晶法除去KNO3中的NaCl |
| C | Cl2可部分与水反应 | 用排饱和食盐水的法收集Cl2 |
| D | Al3+ 易水解 | 不能用蒸干AlCl3溶液的方法制得AlCl3 |
| A、A | B、B | C、C | D、D |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,28g的CO与N2组成的混合气体中含有原子数一定为2NA |
| B、0.1mol?L-1的稀硫酸中含有SO42-个数为0.1NA |
| C、56克铁在氯气中完全燃烧,共转移3NA个电子 |
| D、1L 1mol/L 的盐酸中含有NA个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中可能大量存在Al3+、NH4+、Cl-、AlO2- |
| B、酸性溶液中可能大量存在Na+、MnO4-、SO42-、I- |
| C、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
| D、0.1 mol?L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 |
| V(样品) | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 14.95 | 15.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | CH3COOH溶液的体积/mL | NaOH溶液的体积/mL | 结论 |
| ① | 0 | 20.00 | NaOH溶液pH=13 |
| ② | x | 20.00 | 反应后溶液呈碱性 |
| ③ | y | 20.00 | 反应后溶液呈中性 |
| A、NaOH溶液的浓度等于0.01mol.L-1 |
| B、CH3COOH溶液的浓度可能等于2/x mol.L-1 |
| C、CH3COOH溶液的浓度等于2/y mol.L-1 |
| D、②组反应后混合液中,离子浓度相对大小关系为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g Na2O2与足量水充分反应时电子转移数为NA |
| B、25℃、101.3kPa时,11.2LH2中含有的原子数为NA |
| C、标况下,22.4LH2O 中含有的原子数为3NA |
| D、2L 1mol/L Na2SO4 溶液中离子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Br2 |
| Cu/O2 |
| △ |

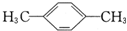 的系统命名为
的系统命名为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com