

| A. | ①②③ | B. | ③④⑤ | C. | ①⑤⑥ | D. | ②③④ |
分析 Zn-Cu原电池中,Zn作负极,负极上锌失电子生成锌离子,Cu作正极,正极上氢离子得电子,电子由负极流向正极,阳离子向正极移动,以此来解答.
解答 解:①Zn为负极,Cu为正极,故①错误;
②H+向正极移动,故②错误;
③电子由Zn电极流向Cu电极,故③正确;
④Cu电极上发生2H++2e-=H2↑,故④正确;
⑤由2H++2e-=H2↑可知,有1mol电子流向导线,产生氢气0.5mol,故⑤正确;
⑥正极反应为2H++2e-=H2↑,故⑥错误;
故选B.
点评 本题考查原电池,为高频考点,把握电极、电极反应、离子和电子的移动方向为解答的关键,侧重分析与应用能力的考查,注意原电池的工作原理,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(2y-x)kJ/mol | |
| B. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(2x-y)kJ/mol | |
| C. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(4x-y)kJ/mol | |
| D. | 2CO2 (g)+2NaOH (1)═2NaHCO3 (1)△H=-(8x-2y)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m>n | B. | m<n | C. | m=n | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
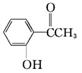 乙:
乙: ,丙:
,丙: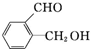
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
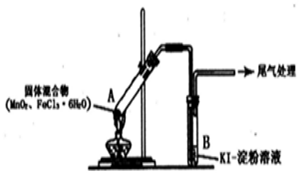
| 实验编号 | 操作 | 现象 |
| 实验1 | 按上图所示加热MnO2与FeCl3•6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验2 | 把A中的混合物换为FeC13•6H2O,B中溶液换为KSCN溶液,加热. | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C=C | C-C | C≡C | C-H |
| E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
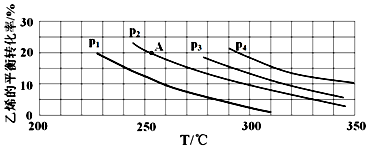
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验 序号 | 时间/min 浓度/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碘化钠溶液中加入新制氯水可看到有紫黑色固体生成 | |
| B. | 向分别装有1gNa2CO3和NaHCO3固体的试管中滴入几滴水,温度高的为Na2CO3 | |
| C. | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,变红,说明样品变质 | |
| D. | 中和热测定时环形玻璃搅拌棒要不断顺时针搅拌,目的是为了混合均匀,充分反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com