
【题目】某烃完全燃烧时,消耗的氧气与生成的CO2体积比为3:2,则该烃的分子式可能为
A. C3H4B. C2H4C. C2H6D. C6H6
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列离子反应,表达正确的是( )
A. 向KHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:2H+ + SO42-+ Ba2+ + 2OH-= BaSO4↓ + 2H2O
B. CaCO3与醋酸反应:CaCO3 + 2H+=Ca2+ + CO2↑+ H2O
C. 向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3—+2OH— =CaCO3↓+CO32—+2H2O
D. MgSO4溶液跟Ba(OH)2溶液反应:SO42― + Ba2+=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时;向2.0L恒容密闭容器中充入1.0mol PCl5;反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s的平均速率v(PCl3)=0.003 2 molL﹣1s﹣1
B.保持其他条件不变;升高温度;平衡时c(PCl3)=0.11 molL﹣1;则反应的△H<0
C.相同温度下;起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2;反应达到平衡前v(正)>v(逆)
D.相同温度下;起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2;达到平衡时;PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+、Fe3+ |
可能大量含有的阴离子 | Cl-、NO3-、SO42-、CO32-、AlO2- |
为探究其成分,进行了探究实验。取一定量的溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示:

(1)该溶液中一定不存在的阳离子是_____________
(2)该溶液中一定不存在的阴离子是_____________
(3)该溶液中含有的阳离子其对应的物质的量浓度之比为____________________________
(4)写出沉淀减少过程中发生反应的离子方程式____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,它们之间能发生如下反应(部分产物未标出)

请根据以上信息回答下列问题:
(1)写出物质B的化学式:___________
(2)写出下列反应的化学方程式:
反应①______________________________________________________________________
反应②______________________________________________________________________
(3)写出下列反应的离子方程式:
反应C→D______________________________________________________________________
反应D→C _____________________________________________________________________
(4)检验D中阳离子的方法: _________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是
选项 | 实 验 | 现 象 |
A | 向氢氧化钠溶液中滴加FeCl3饱和溶液 | 有氢氧化铁胶体产生 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数 ![]() .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中均为化合物的一组是
A. 金刚石、干冰、SO2 B. KCl、盐酸、NaOH
C. CuSO4·5H2O、冰、乙醇 D. 臭氧、CaCO3、铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
肼是一种高能燃料.已经各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如下:
N≡N | O=O | N﹣N | N﹣H | O﹣H | |
键能(KJmol﹣1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l)△H=KJmol﹣1
(2)Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K= .
(3)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.
Fe | H2O(g) | Fe3O4 | H2 | |
甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |
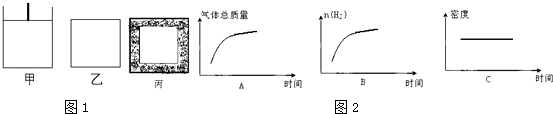
①关于甲、乙容器,下列说法正确的是
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 , 两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是 .
(4)为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
Fe | H2O(g) | Fe3O4 | H2 | |
起始/mol | 3.0 | 3.0 | 0 | 0 |
平衡/mol | m | n | p | q |
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序(用A、B、C表示).
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
25℃时,Fe(OH)3的ksp=4ⅹ10﹣38 , 现有盐酸酸化的0.08mol/L的FeCl3溶液,其PH=1,向其中加入等体积的mol/L的NaOH溶液,可恰好开始析出沉淀(混合时溶液体积可直接加和).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com