
下列叙述或离子方程式书写正确的是
A.将少量二氧化硫通入次氯酸钠溶液中:
SO2+H2O+ClO-===SO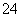 +Cl-+2H+
+Cl-+2H+
B.向含有Fe2O3悬浊液中通入HI气体:
Fe2O3+6H+===2Fe3++3H2O
C.用惰性电极电解MgCl2溶液:
2Cl-+2H2O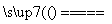 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH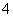 +SO
+SO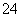 ===BaSO4↓+2NH3·H2O
===BaSO4↓+2NH3·H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列实验能达到预期目的的是( )
A.取加热至亮棕色的纤维素水解液少许,先滴加过量的NaOH溶液,再滴入新制的氢氧化铜悬浊液,加热,有红色沉淀生成,证明其水解产物具有还原性
B.利用银镜反应鉴别麦芽糖和果糖溶液
C.向经唾液充分作用后的苹果中滴入碘水会显蓝色
D.利用FeCl3溶液鉴别乙醇溶液和葡萄糖溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中,还原剂是___▲___还原产物是___▲____。
(2) 该反应中,发生氧化反应的过程是___▲____→___▲____。
(3) 若有0.1 mol KMn04 参加反应,则转移电子的物质的量为 ___▲____mol, 被氧化的HBr的物质的量为 ___▲____ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
密闭容器中一定量的混合气体发生反应:xA(g)+yB(g)  zC(g)
zC(g) ,平衡时,测得A的浓度为0.50 mol/L,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30 mol/L,有关叙述不正确的是( )
,平衡时,测得A的浓度为0.50 mol/L,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30 mol/L,有关叙述不正确的是( )
A.平衡一定向右移动 B.B的转化率升高
C.x+y>z  D.C的体积分数降低
D.C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质的说法中正确的是
A.强电解质一定是离子化合物
B.强电解质、弱电解质的电离都是吸热过程
C.强电解质的饱和溶液一定是浓溶液
D.强电解质在水中一定能全部溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式为
A.碳酸氢钠溶液中滴入氢氧化钙溶液:
HCO +
+ OH-===CO
OH-===CO +H2O
+H2O
B.二氧化硫通入次氯酸钠溶液:
SO2+2ClO-===SO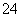 +2Cl-
+2Cl-
C.硫化钡加入稀硫酸:
BaS+2H+===H2S↑+Ba2+
D.新制的氧化铝可溶于氢氧化钠溶液:
Al2O3+2OH-===2AlO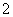 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.NH4HCO3溶于过量的NaOH溶液中:
HCO +OH-===CO
+OH-===CO +H2O
+H2O
B.醋酸溶液与水垢中的CaCO3反应:
CaCO3+2H+===Ca2++H2O+CO2↑
C.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO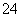 恰好完全沉淀:
恰好完全沉淀:
2Al3++3SO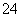 +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
D.向NaAlO2溶液中通入过量CO2:
AlO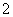 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
PVDC是世界上目前唯一大工业化生产、可以承受高温蒸煮、具有高阻隔性能的塑料,可作为保鲜食品的包装材料,用它作为中间层,制造多层复合材料,更是目前塑料包装行业技术进步和技术创新的前沿阵地。PVDC是聚偏二氯乙烯的英文缩写,它的结构简式是 。下列说法错误的是( )
。下列说法错误的是( )
A.PVDC是由单体CCl2===CH2发生加聚反应合成的
B.PVDC是由单体CCl3CH3发生缩聚反应合成的
C.PVDC也有很大的缺点,如在空气中熔融可分解,分解成为HCl、炭黑、水蒸气等,会污染空气
D.PVDC的单体可发生加成、取代、氧化、消去等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。干法、湿法制备高铁酸盐的原理如下表所示。
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(1) 干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。请完成FeO42-与水反应的方程式:4FeO42-+10H2O  4Fe(OH)3+8OH-+( )
4Fe(OH)3+8OH-+( )
(3)K2FeO4在处理水的过程中能消毒杀菌是因为① ,
它能净水的原因是② 。
(4) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
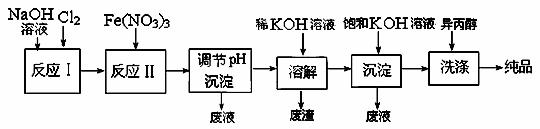
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com