
| A. | 酒精和碘 | B. | 苯和水 | C. | 乙酸和乙酸乙酯 | D. | 乙酸和水 |
分析 互不相同的液体采用分液方法分离,互溶的液体采用蒸馏方法分离,能用分液漏斗分离的混合物,说明这两种物质不互溶,据此分析解答.
解答 解:能用分液漏斗分离的混合物,说明这两种物质不互溶,可以采用分液方法分离,
A.碘易溶于酒精中,所以不能采用分液方法分离,故A错误;
B.苯和水不互溶,二者混合分层,所以可以采用分液方法分离,故B正确;
C.乙酸和乙酸乙酯互溶,所以不能采用分液方法分离,应该采用蒸馏方法分离,故C错误;
D.乙酸和水互溶,所以不能采用分液方法分离,可以采用蒸馏方法分离,故D错误;
故选B.
点评 本题考查物质分离和提纯,明确物质性质及常见物质分离提纯方法是解本题关键,常用的分离方法有:分液、过滤、蒸馏、渗析等.


科目:高中化学 来源: 题型:解答题
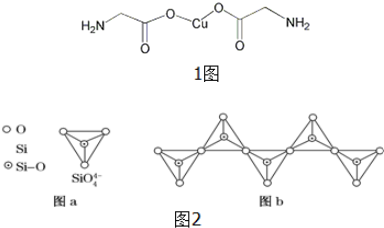
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
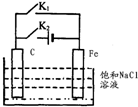
| A. | 断开 K2,闭合 K1时,Fe 电极反应为:2 H++2e-=H2↑ | |
| B. | 断开 K2,闭合 Kl 时,C电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 断开 K1,闭合 K2时,Fe 电极反应为:Fe-2e-=Fe2+ | |
| D. | 断开 Kl,闭合 K2时,C电极反应为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
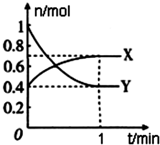 在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.02 mol•L-1 | D. | 0.1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com