
 CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ�Ļ�ѧƷ��Ŀǰ���о�Ŀ�꣮
CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ�Ļ�ѧƷ��Ŀǰ���о�Ŀ�꣮| ���� | CH4 | CO2 | CO | H2 |
| ������� | 0.1 | 0.1 | 0.4 | 0.4 |
���� ��1�������������η���������ʵ����ʵ�����Ȼ���ٸ���ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮����
�ڸ��ݸ�˹���������
��2���ٸ����¶ȶԴ������Ե�Ӱ�죻
�ڸ�����������Ի�ѧƽ���Ӱ�죬ƽ�������ƶ�����Ӧ��ת��������
���Ƚ�Cu2Al2O4������������ʽ��Cu2O•Al2O3���ٸ������������ᷴӦ�������ӷ���ʽ����Ҫע�����һ��ͭ���л�ԭ�ԣ�
��3���Ԣٸ��ݼӾ۷�Ӧ�����������
�ڸ���ԭ���ԭ����CO2������������ԭ��Ӧת��Ϊ���飬ע��������ҺΪ���ԣ�
��� �⣺��1����CO2��g��+CH4��g��?2CO��g��+2H2��g����
��ʼ��mol�� 6 6 0 0
��Ӧ��mol�� x x 2x 2x
ƽ�⣨mol�� 6-x 6-x 2x 2x
��CH4���������Ϊ0.1����$\frac{6-X}{12+2X}$=0.1�����X=4������K=$\frac{{C}^{2}��CO��{C}^{2}��{H}_{2}��}{C\\;��C{O}_{2}��C��C{H}_{4}��}$=$\frac{{2}^{2}��{2}^{2}}{0.5��0.5}$=64��
�ʴ�Ϊ��64��
��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3kJ•mol-1 ��
CO��g��+H2O ��g��=CO2��g��+H2 ��g����H=2.8kJ•mol-1 ��
2CO��g��+O2��g��=2CO2��g����H=-566.0kJ•mol-1 ��
���ݸ�˹���ɣ��ɢ�+�ڡ�2-�ۡ�2�ã�CO2��g��+CH4��g��?2CO��g��+2H2��g����H=-890.3kJ•mol-1+2.8kJ•mol-1��2+566.0kJ•mol-1��2=+247.3 kJ•mol-1��
�ʴ�Ϊ��+247.3 kJ•mol-1��
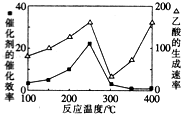
��2�����¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��ͣ������¶����߶�������������ʽ��ͣ��ʴ𰸣��¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��ͣ�
������Ӧѹǿ������CO2��Ũ�ȣ�ƽ�������ƶ�����Ӧ��ת�������ʴ�Ϊ������Ӧѹǿ������CO2��Ũ�ȣ�
��Cu2Al2O4������������ʽ��Cu2O•Al2O3�����ᷴӦ�������ӷ���ʽ��3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
�ʴ�Ϊ��3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
��3����CO2�����Ӿ۷�Ӧ�õ����ʴ�Ϊ��
��
��CO2������������ԭ��Ӧת��Ϊ���飬�缫��ӦΪ��CO2+8e-+6H2O=CH4+8OH-���ʴ�Ϊ��CO2+8e-+6H2O=CH4+8OH-��
���� ������Ҫ�����˻�ѧ��Ӧ��������ѧƽ���Լ�ԭ���ԭ�������ã��ѶȲ�������ѧ֪ʶ������ɣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H2����H3��2��H1 | B�� | ��H1����H2����H3 | C�� | ��H2����H1����H3 | D�� | ��H3����H2��2��Hl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ͼ�����建��ͨ��ʢ�������Լ����Լ�ƿA�����Թ�B�п��Թ۲쵽����������ǣ�������
��ͼ�����建��ͨ��ʢ�������Լ����Լ�ƿA�����Թ�B�п��Թ۲쵽����������ǣ�������| ѡ�� | ���� | A���Լ� | B���Լ� |
| A | SO2��CO2 | ����KMnO4��Һ | Ʒ����Һ |
| B | Cl2��HCl | Ũ���� | KI������Һ |
| C | NH3��CO2 | Ũ���� | ��̪��Һ |
| D | C2H4��CH4 | ����KMnO4��Һ | ���CCl4��Һ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
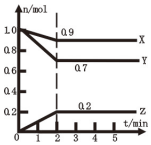 ��1��ij�¶�ʱ����2L������X��Y��Z�����������ʵ����ʵ�����n������ʱ�䣨t���仯��������ͼ��ʾ��
��1��ij�¶�ʱ����2L������X��Y��Z�����������ʵ����ʵ�����n������ʱ�䣨t���仯��������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �ȼ��仯�������������������й㷺����;���ش��������⣺
�ȼ��仯�������������������й㷺����;���ش��������⣺| ������� | �¶�/ | �������/L | ClO2��g����ƽ��ת���� |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | 0 | 1 | 3 | 5 |
| n��H2��/mol | 8 | 5 | 4 | 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ѹǿ �¶� | 1��105Pa | 5��105Pa | 10��105Pa | 50��105Pa | 100��105Pa |
| 450�� | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500�� | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com