
| A. | 丙烷是直链烃,所以分子中3个碳原子也在一条直线上 | |
| B. | 丙烯所有原子均在同一平面上 | |
| C. | 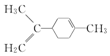 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 | |
| D. |  至少有16个原子共平面,至少8原子共线 至少有16个原子共平面,至少8原子共线 |
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
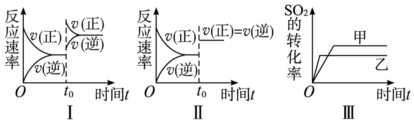
| A. | 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响 | |
| B. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低 | |
| C. | 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高 | |
| D. | 图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{44}$ mol-1 | B. | $\frac{x}{22}$ mol-1 | C. | $\frac{3x}{44}$ mol-1 | D. | $\frac{44x}{3}$ mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
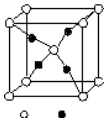 周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;
周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
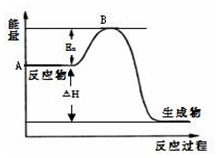 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质不一定能导电 | |
| B. | 氨溶于水得到的氨水能导电,所以氨水是电解质 | |
| C. | 将硫酸钡放入水中不能导电,所以硫酸钡是非电解质 | |
| D. | 在水溶液或熔融状态下能导电的物质叫做电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com