
【题目】无色而有刺激性气味的甲酸,是最简单的羧酸液体,熔点8.6℃,沸点100.8℃。化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为:HCOOH![]() CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸。
CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸。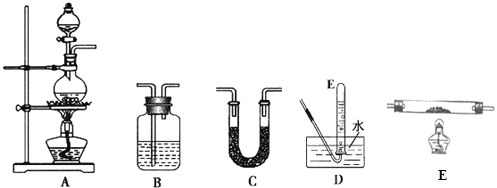
(1)请从图中选用所需的仪器(仪器可重复使用)组成一套验证甲酸(HCOOH)和浓硫酸加热生成产物的实验装置。现提供以下药品:甲酸、浓硫酸、无水硫酸铜、氧化铜粉末、澄清石灰水。将所用仪器的序号按连接顺序由上至下依次填入下表(可以不填满),并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写)。___
选用的仪器 | 加入的试剂 |
A | 甲酸、浓硫酸 |
D | -- |
证明有一氧化碳生成的现象是___。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)24H2O]晶体。查阅资料可知四水甲酸铜晶体为浅蓝色晶体,可溶于水,难溶于醇。
相关的化学方程式是:2CuSO4+4NaHCO3=Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4+H2O;Cu(OH)2CuCO3+4HCOOH+5H2O=2Cu(HCOO)24H2O+CO2↑
实验步骤如下:
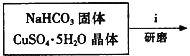
Ⅰ.碱式碳酸铜的制备:
![]()
![]()
①步骤ⅰ是将一定量CuSO45H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是___。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到___(填写实验现象),说明温度过高。
Ⅱ.甲酸铜的制备:将Cu(OH)2CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的![]() 时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
③制取甲酸铜时需要趁热过滤的原因是___。
④用无水乙醇洗涤晶体的目的是___
【答案】
选用的仪器 | 加入的试剂 |
A | 甲酸、浓硫酸 |
C | 无水硫酸铜 |
B | 浓硫酸 |
E | 氧化铜粉末 |
B | 澄清石灰水 |
D | -- |
E中氧化铜粉末变红,E后B装置中澄清石灰水变浑浊 研细并混合均匀 有黑色固体生成 防止甲酸铜晶体析出 减少晶体的损耗以及洗去晶体表面的水和其它杂质
【解析】
(1)在装置A中进行,根据甲酸分解的方程式,产生成CO和水蒸气,根据实验目的,先验证水,即气体先通过盛有无水硫酸铜的装置C,如果固体变蓝,说明含有水蒸气,通过盛有浓硫酸的装置B,除去水蒸气,然后将气体通入盛有CuO的E装置,再将气体通入盛有澄清石灰水的B装置,如果澄清石灰水变浑浊,则说明含有CO,据此分析;
(2)①放到研钵中研磨增大接触面积,加快反应速率;
②碱式碳酸铜受热易分解,生成黑色的氧化铜;
③甲酸铜的溶解度随温度的升高而变大;
④根据“相似相溶原理”,可知甲酸铜易溶于水,难溶于有机溶剂。
(1)在A装置中进行,甲酸![]() 分解的方程式为:HCOOH
分解的方程式为:HCOOH![]() CO2↑+H2O,先通过在C装置中无水硫酸铜,固体变蓝,接着通过B装置中浓硫酸除去水用来干燥气体,然后将气体通入E装置与氧化铜反应,氧化铜粉末变红,再将生成的气体通入B装置的澄清石灰水,澄清石灰水变浑浊,即可判断分解产物中有CO生成;
CO2↑+H2O,先通过在C装置中无水硫酸铜,固体变蓝,接着通过B装置中浓硫酸除去水用来干燥气体,然后将气体通入E装置与氧化铜反应,氧化铜粉末变红,再将生成的气体通入B装置的澄清石灰水,澄清石灰水变浑浊,即可判断分解产物中有CO生成;
故答案为:
选用的仪器 | 加入的试剂 |
A | 甲酸、浓硫酸 |
C | 无水硫酸铜 |
B | 浓硫酸 |
E | 氧化铜粉 |
B | 澄清石灰水 |
D | -- |
E中氧化铜粉末变红,E后B装置中澄清石灰水变浑浊;
(2)Ⅰ、![]() 研磨的作用是把药品研细并混合均匀;
研磨的作用是把药品研细并混合均匀;
故答案为:研细并混合均匀;
![]() 温度过高,
温度过高,![]() 会分解生成黑色的氧化铜 ;
会分解生成黑色的氧化铜 ;
故答案为:有黑色固体生成;
Ⅱ、![]() 甲酸铜的溶解度随温度的升高而变大,如果冷却,会有晶体析出,降低产率,因此需趁热过滤;
甲酸铜的溶解度随温度的升高而变大,如果冷却,会有晶体析出,降低产率,因此需趁热过滤;
故答案为:防止甲酸铜晶体析出;
![]() 甲酸铜易溶于水,不能用蒸馏水洗涤,故需用乙醇进行洗涤,减少晶体的损耗以及洗去晶体表面的水和其它杂质;
甲酸铜易溶于水,不能用蒸馏水洗涤,故需用乙醇进行洗涤,减少晶体的损耗以及洗去晶体表面的水和其它杂质;
故答案为:减少晶体的损耗以及洗去晶体表面的水和其它杂质。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中国科学院研究员马大为以氨基酸铜的络合物为催化剂实现了碳![]() 氮键的高效构筑,为含苯胺片段的药物及材料的合成提供了一种简便、实用的方法,马大为借助这一研究也获得了“未来科学大奖物质科学奖”。如图是一种氨基酸铜的络合物的结构简式。
氮键的高效构筑,为含苯胺片段的药物及材料的合成提供了一种简便、实用的方法,马大为借助这一研究也获得了“未来科学大奖物质科学奖”。如图是一种氨基酸铜的络合物的结构简式。
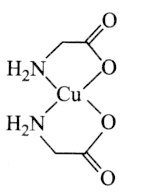
回答下列问题:
![]() 基态铜原子的最外层电子所处的原子轨道的形状为________,某同学查阅资料发现铜有
基态铜原子的最外层电子所处的原子轨道的形状为________,某同学查阅资料发现铜有![]() 价,则基态
价,则基态![]() 的价电子轨道表达式为________。
的价电子轨道表达式为________。
![]() 、C、N、O四种元素的第一电离能由大到小的顺序为________
、C、N、O四种元素的第一电离能由大到小的顺序为________![]() 用元素符号表示
用元素符号表示![]() ;该氨基酸铜中碳原子的杂化方式为________;
;该氨基酸铜中碳原子的杂化方式为________;![]() 氨基酸铜中含有________
氨基酸铜中含有________![]() 键。
键。
![]() 、O元素可形成多种微粒,
、O元素可形成多种微粒,![]() 的空间构型为________,写出一种与
的空间构型为________,写出一种与![]() 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
![]() 铜晶体是面心立方结构,铜晶体的空间利用率为________;配位数为________。
铜晶体是面心立方结构,铜晶体的空间利用率为________;配位数为________。
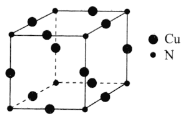
![]() 铜元素与氮元素形成的一种晶体的立方晶胞如图所示,该晶体的化学式为________,两个最近的氮原子之间的距离为anm,
铜元素与氮元素形成的一种晶体的立方晶胞如图所示,该晶体的化学式为________,两个最近的氮原子之间的距离为anm,![]() 表示阿伏加德罗常数的值,则该晶体的密度为________
表示阿伏加德罗常数的值,则该晶体的密度为________![]() 用含a、
用含a、![]() 的代数式表示
的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子可能大量共存的是
A.遇酚酞变红的溶液中:Na+、Cl-、Ba2+、CH3COO-
B.常温下,![]() =1×10-13mol·L-1的溶液中:SO
=1×10-13mol·L-1的溶液中:SO![]() 、Fe2+、ClO-、NH
、Fe2+、ClO-、NH![]()
C.水电离出的c(H+)=10-10mol·L-1的溶液中:Na+、K+、Cl-、HCO![]()
D.滴加KSCN溶液显红色的溶液中:NH![]() 、K+、Cl-、I-
、K+、Cl-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)ClO2的制备及性质探究装置如图:

①仪器a的名称为___,装置B的作用是___。
②装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为___。装置D的作用是___。
③ClO2可用于处理碱性含硫废水(硫被氧化为最高价态),ClO2与Na2S溶液反应的离子方程式为___。
④装置E用于吸收尾气,反应可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO23H2O,在温度高于38℃时析出的晶体是NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
ⅰ.___;
ⅱ.___;
ⅲ.洗涤;
ⅳ.干燥。
(2)测定生成ClO2的质量
实验步骤如下:
a.取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤装置D2~3次,并将洗涤液一并转移到容量瓶中,加蒸馏水稀释至刻度。
b.从容量瓶中取出25.00mL溶液于锥形瓶中,用0.1000molL-1硫代硫酸钠标准溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI),指示剂显示终点时消耗硫代硫酸钠溶液24.00mL。
①滴定至终点的现象是___。
②进入装置D中的ClO2的质量为___。
③若滴定开始仰视读数,滴定终点时正确读数,则测定结果___(填偏高偏低或不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的资源。A~F是常见有机物,它们之间的转化关系如图1所示(部分产物和反应条件已略去),其中A的产量可以用来衡量一个国家的石油化工发展水平,E是最简单的芳香烃。回答下列问题:

(1)步骤②所用试剂X为___________(写化学式),D的官能团名称是_______;
(2)F的结构简式为________________,步骤①的反应类型:___________;
(3)写出下列步骤中的化学方程式(注明反应条件):
步骤③_____________________________________;
步骤④_______________________________________;
(4)用图2所示实验装置制取乙酸乙酯。请回答:试管b中所装溶液应为_____,乙酸乙酯生成后,分离出产品时的操作方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.NF3和BF3的杂化方式不同,前者是sp2后者是sp3
C.HCHO、CH3—、SO3的分子空间构型相同
D.由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子
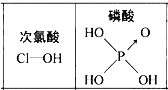
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组利用图1装置来制备1,2-二溴乙烷,利用图2装置来进一步精制。1,2-二溴乙烷是无色液体,密度为2.18g·cm-3,沸点为131.4℃,熔点为9.79℃,微溶于水,易溶于乙醇、乙醚、丙酮等有机溶剂。实验前将无水乙醇和浓硫酸按体积比1:3混合制得乙烯制备液。
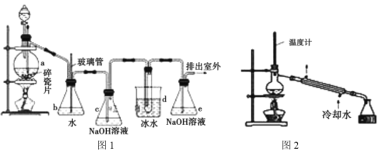
I.制备粗品
实验步骤:连接好装置,检查装置的气密性,分液漏斗中装乙烯制备液,d中装适量的液溴(表面覆盖少量水),其他药品按图1加入,打开分液漏斗旋塞滴入适量的液体后,关闭旋塞,点燃酒精灯加热使温度迅速升高到170℃直至反应完全,停止加热。回答下列问题:
(1)仪器a的名称为 _______,b装置的作用为 ___________ 。
(2)d装置中发生反应的化学方程式为 ___________ 。
(3)如果缺少C装置会导致1,2-二溴乙烷的产率降低,原因是___________(用离子方程式表示)。
(4)判断d中液溴反应完全的标准是 _____________。
II.制备精品
(5)d中制得的1,2-二溴乙烷中含有水,可先用__________方法进行分离,再将1,2 二溴乙烷用如图2 装置进行蒸馏,蒸馏时加入无水 Na2SO4的目的是_________,收集产品时,温度应控制在______左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙炔酸甲酯(CH≡C-COOCH3 )是一种重要的有机化工原料,沸点为103℃。实验室制备少量丙炔酸甲酯的反应为:CH≡C-COOH+CH3OH![]() CH≡C-COOCH3+H2O。实验步骤如下:
CH≡C-COOCH3+H2O。实验步骤如下:
步骤1:在反应瓶中加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌加热回流一段时间;
步骤2:蒸出过量的甲醇(装置见图);
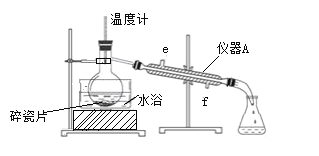
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤,分离出有机相;
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得7.56g丙炔酸甲酯。
(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤2中,图中所示的装置中仪器A的名称是________,自来水从________(填“e”或“f”)进入该仪器;加入碎瓷片的目的是________。
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是________;分离出有机相的操作名称为________。
(4)步骤4中,蒸馏时不能用水浴加热的原因是________。
(5)丙炔酸甲酯的产率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com