


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42- |
| B、加盐酸生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
| C、用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+ |
| D、加入NaOH溶液,生成的白色沉淀在空气中迅速变为灰绿色,最终变为红褐色,则原溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
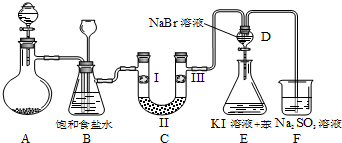
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由C(石墨)→C(金刚石)△H=+1.9 kJ?mol-1可知,金刚石比石墨稳定 |
| C、在稀溶液中:H++OH-=H2O△H=-57.3 kJ?mol-1,若将含1 mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ |
| D、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅的水溶液显酸性,所以,二氧化硅是酸性氧化物 |
| B、二氧化碳通入水玻璃可得到硅酸,说明碳酸的酸性比硅酸强 |
| C、高温时二氧化硅与纯碱反应放了二氧化碳,所以硅酸的酸性比碳酸强 |
| D、二氧化硅是酸性氧化物,因此,它不能溶于任何酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com