
���� ��1������v=$\frac{��c}{��t}$�����a������ǰ10minƽ����Ӧ����v��D����Ȼ�����û�ѧ��Ӧ�����뻯ѧ�����������ȼ����v��C����
��2��aΪ���º��ݣ�bΪ���º�ѹ���÷�ӦΪ���������С�ķ�Ӧ����Ӧ������b��ѹǿ�ϴ��ѹǿ�Ի�ѧƽ�⡢��ѧ��Ӧ���ʵ�Ӱ���жϣ�
��3�����г���ѧƽ������ʽ��Ȼ����ת���ʼ���ѧƽ�ⳣ���ı���ʽK=$\frac{{c}^{2}��C��•c��D��}{{c}^{3}��A��•c��B��}$���㣮
��� �⣺��1��10min��a�д�ƽ�⣬������D��Ũ��Ϊ0.05mol•L-1�����ʱ�������D��ʾ�ķ�Ӧ����Ϊ��v��D��=$\frac{0.05mol/L}{10min}$=0.005mol/��L•min�������ݻ�ѧ��Ӧ�����뻯ѧ�����������ȿ�֪��v��C��=2v��D��=0.01mol/��L•min����
�ʴ�Ϊ��0.01mol/��L•min����
��2����ͬ�¶��£�aΪ���º��ݣ�bΪ���º�ѹ�����÷�ӦΪ���������С�ķ�Ӧ����Ӧ������a��ѹǿ��С��b��ѹǿ�ϴ���ﵽƽ��ʱb��a��ȣ�ƽ�����������ƶ�����d��0.05mol•L-1��ѹǿԽ��Ӧ����Խ�죬��a�з�Ӧ����С��b������b�ﵽƽ������ʱ��t��10min��
�ʴ�Ϊ����������
��3��3A������+B������?2C������+D��������
��Ӧǰ��mol/L��0.25 0.1 0 0
ת����mol/L�� 0.15 0.05 0.1 0.05
ƽ��ʱ��mol/L��0.1 0.05 0.1 0.05
ƽ��ʱa������B���ʵ�ת����Ϊ��$\frac{0.05mol/L}{0.1mol/L}$��100%=50%��
���¶��·�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ��K=$\frac{{c}^{2}��C��•c��D��}{{c}^{3}��A��•c��B��}$=$\frac{0��{1}^{2}��0.05}{0��{1}^{3}��0.05}$=10��
��ƽ��ʱa������B��ת����Ϊ50%�����¶��µ�ƽ�ⳣ�� K=10��
���� ���⿼���˻�ѧƽ��ļ��㣬��Ŀ�Ѷ��еȣ��漰��ѧƽ�⼰��Ӱ�졢��ѧ��Ӧ���ʡ�ת���ʼ���ѧƽ�ⳣ���ļ��㣬ע����������ʽ�ڻ�ѧƽ������е�Ӧ�÷���������������ѧ���Ļ�ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
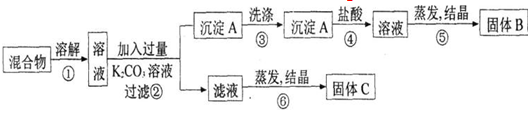
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������һ�и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
ij��ѧ��ȤС��ͬѧչ����Ư����������(NaClO2)���о���
ʵ���. ��ȡNaClO2����
��֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2��3H2O������38��ʱ�����ľ�����NaClO2������60 ��ʱNaClO2�ֽ��NaClO3��NaCl����������ͼ��ʾװ�ý���ʵ�顣
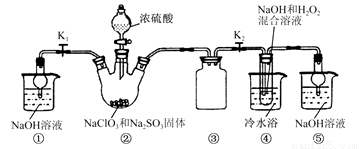
(1) װ�â��в���ClO2����Ļ�ѧ����ʽΪ ��
װ�â����Ʊ�NaClO2�Ļ�ѧ����ʽΪ ��
(2) װ�â۵������� ��
(3) ��װ�âܷ�Ӧ�����Һ���NaClO2����IJ����������£�
�ټ�ѹ��55�������ᾧ���ڳ��ȹ��ˣ��� ���ܵ���60 �����õ���Ʒ��
ʵ��II. �ⶨij����������Ʒ�Ĵ���
�������ʵ�鷽����������ʵ�飺
�ٳ�ȡ��������������Ʒm g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ(��֪��ClO2?+4I?+4H+==2H2O+2I2+Cl?)�������û��Һ���250 mL������Һ��
����ȡ25.00 mL������Һ����ƿ�У��Ӽ��ε�����Һ����c mol��L?1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ����ƽ��ֵΪV mL(��֪��I2+2S2O32?=2I?+S4O62?)��
(4) �ﵽ�ζ��յ�ʱ������Ϊ ��
(5) ����Ʒ��NaClO2����������Ϊ (�ú�m��c��V�Ĵ���ʽ��ʾ)��
(6) �ڵζ�������ȷ���������£���ʵ���ý��ƫ�ߣ�ԭ�������ӷ���ʽ��ʾΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 4.1��106 | K1 | K2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 �ش��������⣺
�ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������еμӰ�ˮ��H++OH-�TH2O | |
| B�� | �Ȼ�����̼�������Һ��ϣ�Ca2++CO32-�TCaCO3�� | |
| C�� | ���������к�θ�Al��OH��3+3H+�TAl3++3H2O | |
| D�� | Ca��HCO3��2��Һ�м������KOH��Һ��Ca2++HCO3-+OH-�TCaCO3��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢ� | B�� | �٢ۢ� | C�� | �٢ݢ� | D�� | �٢ܢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com