
| A. | 漂白粉是混合物,有效成分是CaCl2 | |
| B. | 光照氯水有气泡逸出,该气体是Cl2 | |
| C. | Cl2能使湿润的有色布条褪色,说明Cl2具有漂白性 | |
| D. | 实验室用二氧化锰与浓盐酸反应制取Cl2 |
分析 A.漂白粉是氯化钙和次氯酸钙的混合物,有效成分为次氯酸钙;
B.氯水中存在化学平衡,氯气和水反应生成盐酸和次氯酸,次氯酸见光易分解生成氧气;
C.氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白作用;
D.二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水.
解答 解:A.氯气和石灰乳反应生成氯化钙、次氯酸钙和水,次氯酸钙能和酸反应生成次氯酸,次氯酸具有漂白性,所以漂白粉的有效成分是Ca(ClO)2,故A错误;
B.氯水中存在化学平衡,氯气和水反应生成盐酸和次氯酸,次氯酸见光易分解生成氧气,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2,气体为氧气,故B错误;
C.氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白作用,氯气无漂白作用,故C错误;
D.二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,是实验室制备氯气的方法,MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故D正确;
故选D.
点评 本题考查了漂白粉的有效成分,氯气的性质、实验室制备方法,注意次氯酸具有漂白性、不稳定性、强氧化性,熟练掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LO2含有的O2分子个数为NA | |
| B. | 在标准状况下,4.48L H2O中所含的原子总数为0.6NA | |
| C. | 40 g NaOH溶解在1 L水中,所制得的溶液,物质的量浓度为1mol•L-1 | |
| D. | 常温常压下,22g CO2含有的原子个数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
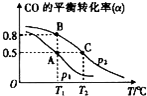 SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.
SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
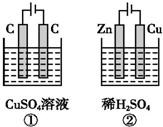 如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 产生气体的总体积:①>② | |
| B. | 电极上析出物质的总质量:②>① | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | ①中阳极的电极反应式:4OH--4e-═2H2O+O2↑;②中阴极的电极反应式:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 加入Al能放出H2的溶液中:NH+4、Cl-、SO2-4、HCO-3 | |
| C. | 在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- | |
| D. | 由水电离的c(OH-)=10-13mol•L-1的溶液中:Ba2+、Cl-、Na+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=11的Na2SO3溶液中,水电离的c(H+)=1.0×10-11mol/L | |
| B. | 将0.2mol•L-1盐酸与0.1mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由小到大的顺序:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) | |
| C. | 浓度相同的①NH4Cl②(NH4)2SO4③(NH4)2CO3④NH4HSO4四种溶液,c(NH4+)大小顺序为:②>③>④>① | |
| D. | pH=4的NaHC2O4溶液中存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com