
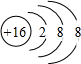
 离子的六种溶液,向每种溶液中分别加入少量氢氧化钠固体、少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是( )
离子的六种溶液,向每种溶液中分别加入少量氢氧化钠固体、少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是( )| A. | ①②④ | B. | ②③⑤ | C. | ①④ | D. | ③⑤⑥ |
分析 ①HSO3-能够与氢氧化钠过量、盐酸和酸性高锰酸钾溶液反应;
②10电子并含两个原子核的一价阴离子是OH-,氢氧根离子不与酸性高锰酸钾溶液中的氢离子反应;
③亚硫酸根离子不与氢氧化钠固体反应,离子数目不变;
④HS-与氢氧化钠固体、盐酸、酸性高锰酸钾溶液反应;
⑤26M2+为Fe2+,亚铁离子不与盐酸反应;
⑥ 为S2-,硫离子不与氢氧根离子反应,据此进行解答.
为S2-,硫离子不与氢氧根离子反应,据此进行解答.
解答 解:①HSO3-:亚硫酸氢根离子能够与氢氧化钠过量、盐酸和酸性高锰酸钾溶液反应,导致其离子数目减少,故①正确;
②10电子并含两个原子核的一价阴离子是OH-:氢氧根离子不与酸性高锰酸钾溶液中的氢离子反应,离子数目不变,故②错误;
③SO32-:亚硫酸根离子与氢离子、酸性高锰酸根离子反应,不与氢氧化钠固体反应,离子数目不变,故③错误;
④HS-与氢氧化钠固体、盐酸、酸性高锰酸钾溶液反应,导致 离子数目减少,故④正确;
⑤26M2+为Fe2+,亚铁离子不与盐酸反应,加入少量盐酸后亚铁离子数目不变,故⑤错误;
⑥ 为S2-,硫离子不与氢氧根离子反应,加入氢氧化钠固体后硫离子数目不变,故⑥错误;
为S2-,硫离子不与氢氧根离子反应,加入氢氧化钠固体后硫离子数目不变,故⑥错误;
故选A.
点评 本题考查氧化还原反应,题目难度中等,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,为高频考点,注意题给信息,学习中注重相关基础知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 金属 | 实验操作 | 实验现象 |
| 甲 | ①取少量粉末,加入过量浓硝酸 ②向上述溶液中加入几滴NaCl溶液 | 粉末溶解,有红棕色气体产生 有白色沉淀生成 |
| 乙 | ③取少量粉末,加入足量NaOH溶液 ④向上述溶液中逐滴加入稀盐酸 ⑤继续加入过量的稀盐酸 | 粉末溶解,有气泡产生 有白色沉淀生成 白色沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 18O含有的中子数为10NA | |
| B. | 22.4L甲烷气体中所含分子数目为NA | |
| C. | 1L 0.1mol•L-1NH4Cl 溶液中NH4+数目为 0.1NA | |
| D. | 1L pH=1的醋酸溶液中,CH3COOH分子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制FeSO4溶液时,加入一些铁粉 | |
| B. | 500℃左右比室温更有利于合成氨的反应 | |
| C. | 实验室常用排饱和食盐水的方法收集氯气 | |
| D. | 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系| A. | 物质的量之比为3:2 | B. | 质量之比为2:3 | ||
| C. | 摩尔质量之比为2:3 | D. | 反应速率之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度为0.2mol/L的CH3COOH溶液和农地为0.1mol/L的NaOH溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 醋酸溶液加少量水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$几乎不变 | |
| D. | amol/LCH3COOH溶液与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CH3COO-),则一定有a≤b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,容器体积扩大一倍,A的浓度是原来的0.45倍,则a+b>c+d | |
| B. | 若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为b:a | |
| C. | 若平衡体系中共有气体n mol,再向其中充入bmolB,达到平衡时气体总物质的量为n+bmol,则a+b=c+d | |
| D. | 若a+b=c+d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
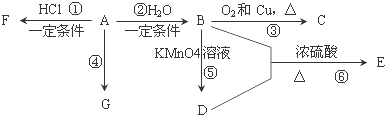
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com