
分析 (1)利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应;2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m为2Na2CO3-2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m为2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量;
(2)氧化钠、过氧化钠与水反应后的溶质为氢氧化钠,根据n=$\frac{m}{V}$计算出氢氧化钠的物质的量,再根据质量守恒、钠原子守恒列式计算出氧化钠、过氧化钠的物质的量,最后根据c=$\frac{n}{V}$计算出氢氧根离子的物质的量、根据过氧化钠与水的反应方程式计算出生成的标况下氧气的体积;
(3)生成标准状况下气体体积为5.6L,物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,所以过氧化钠的物质的量为0.5mol,所以氢氧化钠的物质的量为:0.5mol×2=1mol,沉淀质量为5.8克,即氢氧化镁的质量为5.8克,所以氢氧化镁的物质的量为:$\frac{5.8g}{58g/mol}$=0.1mol,生成氢氧化镁消耗氢氧根离子的物质的量为0.1×2=0.2mol,则铝离子转化为偏铝酸根离子消耗氢氧根的物质的量为0.8,所以铝离子的物质的量为0.2mol,所以溶液中硫酸根离子的物质的量为:0.3+0.1=0.4mol,则c=$\frac{0.4mol}{0.2L}$=2mol/L;
(4)①设Na2O2 和NaHCO3的物质的量分别为x,y
2Na2O2+4NaHCO3=4Na2CO3+2H2O↑+O2↑
492 424
17.88 15.41
2Na2O2+2NaHCO3=2Na2CO3+2NaOH+O2↑
324 292
17.88 16.11
15.41<15.92<16.11 说明两个反应都发生
所以78x+84y=17.88 106y+(2x-y)×40=15.92
解之得:x=0.1mol、y=0.12mol
所以m(Na2O2)=7.8g;
②反应后固体为0.08mol的NaOH和0.12mol的Na2CO3,当反应后溶质为NaCl、NaHCO3时,则需盐酸体积为200mL;当反应后溶质只有NaCl时,则需盐酸体积为320mL
所以盐酸体积为200mL≤V≤320mL,由此解答.
解答 解:(1)CO和H2的混合气体燃烧的方程式:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,与Na2O2反应的方程式:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,通过方程式可以看出,固体质量的增加量就是原混合气体的质量,为mg,故答案为:m;
(2)设14.0g混合物中含有氧化钠xmol,含有过氧化钠ymol,则①62x+78y=14,最后得到的溶质为NaOH,得到400mL pH=14的溶液,氢氧化钠的物质的量为:0.4×1=0.4mol,根据钠原子守恒可得:②2x+2y=0.4,联合①②解得:x=0.1、y=0.1,所以0.1mol的过氧化钠生成0.05mol的氧气,标况下生成的氧气的体积为:V(O2)=22.4L/mol×0.05mol=1.12L,故答案为:1.12;
(3)生成标准状况下气体体积为5.6L,物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,所以过氧化钠的物质的量为0.5mol,所以氢氧化钠的物质的量为:0.5mol×2=1mol,沉淀质量为5.8克,即氢氧化镁的质量为5.8克,所以氢氧化镁的物质的量为:$\frac{5.8g}{58g/mol}$=0.1mol,生成氢氧化镁消耗氢氧根离子的物质的量为0.1×2=0.2mol,则铝离子转化为偏铝酸根离子消耗氢氧根的物质的量为0.8,所以铝离子的物质的量为0.2mol,所以溶液中硫酸根离子的物质的量为:0.3+0.1=0.4mol,则c=$\frac{0.4mol}{0.2L}$=2mol/L,故答案为:2;
(4)①设Na2O2 和NaHCO3的物质的量分别为x,y
2Na2O2+4NaHCO3=4Na2CO3+2H2O↑+O2↑
492 424
17.88 15.41
2Na2O2+2NaHCO3=2Na2CO3+2NaOH+O2↑
324 292
17.88 16.11
15.41<15.92<16.11 说明两个反应都发生
所以78x+84y=17.88 106y+(2x-y)×40=15.92
解之得:x=0.1mol、y=0.12mol
所以m(Na2O2)=7.8g,答:原混合物中Na2O2的质量为7.8g;
②反应后固体为0.08mol的NaOH和0.12mol的Na2CO3,当反应后溶质为NaCl、NaHCO3时,则需盐酸体积为200mL;当反应后溶质只有NaCl时,则需盐酸体积为320mL
所以盐酸体积为200mL≤V≤320mL,答:需要1mol/L盐酸的体积为200mL≤V≤320mL.
点评 本题考查了有关物质的量的计算、混合物的计算,题目难度中等,注意掌握有关物质的量的计算方法,明确质量守恒定律、极值法在化学计算中的应用,试题有利于提高学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 还原性:As3->Br->Cl- | B. | 熔点:As>Br2>Cl2 | ||
| C. | 原子半径:As>Br>Cl | D. | 酸性:HCl>HBr>AsH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 | |
| B. | 2mL10%的NaOH溶液中滴加2%的CuSO4溶液4~6滴制得新制氢氧化铜 | |
| C. | 将水蒸气通过灼热的铁粉,铁粉变红棕色,说明铁与水在高温下能发生反应 | |
| D. | 取a克Na2CO3和NaHCO3混合物与少量稀盐酸充分反应,加热、蒸干、灼烧至熔化,冷却得b克固体,可测得Na2CO3质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| B. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 | |
| C. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝熔点高于铝 | |
| D. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
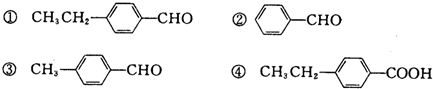
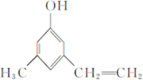 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的单质在自然界只有一种核素 | |
| B. | E的单质与任何物质反应,都只表现氧化性 | |
| C. | 元素C、D、E的原子中,原子半径依次减小 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热氯化铵固体制取氨气 | |
| B. | 检验乙醇中是否含水:用无水硫酸铜,观察是否变蓝色 | |
| C. | 除去乙醛中的乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 滴有酚酞的碳酸钠中,加入氯化钡溶液后,红色变浅,证明碳酸钠溶液中存在水解平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com