
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是( )
①生成物的质量分数一定增加 ②任一生成物总量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥一定使用催化剂
A.①②③ B.③④⑤ C.②⑤ D.④⑥
科目:高中化学 来源: 题型:
在5.6 g Fe粉中加入过量的稀硫酸,待反应完全后,再加入1 mol·L-1 KNO3溶液25 mL,恰好反应完全。该反应的方程式为FeSO4+KNO3+H2SO4―→K2SO4+Fe2(SO4)3+NxOy+H2O(未配平),则对该反应的下列说法正确的是( )
A.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
B.反应中氧化产物是N2O
C.反应过程中转移的电子为8 mol电子
D.氧化产物和还原产物的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.在0℃时,22.4 L氢气中含有2NA个氢原子
B.电解食盐水若产生2 g氢气,则转移的电子数目为NA
C.1 mol乙烷分子中共价键总数为7NA
D.密闭容器中46 g NO2含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、环境等密切相关。下列说法错误的是( )
A.“低碳经济”是指减少对化石燃料的依赖,达到低污染、低排放的模式
B.“低碳生活”倡导生活中耗用能量尽量减少,从而减少CO2的排放
C.所有垃圾都可以采用露天焚烧或深埋的方法处理
D.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
查看答案和解析>>
科目:高中化学 来源: 题型:
FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某化学研究小组为探究在酒精喷灯加热条件下FeSO4分解的气体产物,进行了一系列实验。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。
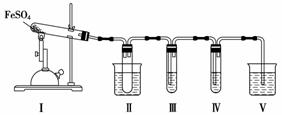
请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是__________________________,试管浸泡在50 ℃的水中,其目的是____________________。
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分。请完成实验设计,填写检验试剂、预期现象与结论。限选试剂:3 mol·L-1 H2SO4溶液、6 mol·L-1 NaOH溶液、0.5 mol·L-1 BaCl2溶液、0.5 mol·L-1 Ba(NO3)2溶液、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水。
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有______________ | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有____________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是__________。
(4)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄。
①甲同学推测该反应的还原产物有两种可能:a.Cl2、b:Cl-。
乙同学结合甲同学的推测,认为其中一种可能可以排除,你认为可以排除的是哪种可能,并用简要的文字和离子方程式说明理由:________________。
②上述反应的离子方程式为__________________。
③为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:__________(填序号)。
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g) 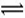 C(g)+D(g),5min后达到平衡,各物质的平衡浓度有如下关系:c
C(g)+D(g),5min后达到平衡,各物质的平衡浓度有如下关系:c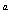 (A)×c(B)=c(C) ×c(D)。若在此温度下,将容器的体积扩大为原来的10倍,B的转化率不变,则此时A的转化率( )
(A)×c(B)=c(C) ×c(D)。若在此温度下,将容器的体积扩大为原来的10倍,B的转化率不变,则此时A的转化率( )
A.60% B.40% C.20% D.10%
查看答案和解析>>
科目:高中化学 来源: 题型:
将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g)+aQ(g)。2 min达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述错误的是( )
A.a的值为1 B.平衡时X的浓度为0.8 mol/L
C.Y的转化率为60% D.反应速率v(Y)=0.3 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如右图所示。下列说法中正确的是 ( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如右图所示。下列说法中正确的是 ( )
A.8 min时表示正反应速率等于逆反应速率
B.前20 min A的反应速率为0.051mol·L-1·min-1
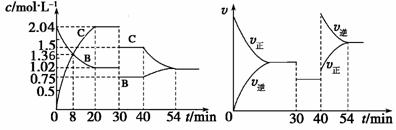 C.反应方程式中的x=1则30 min时表示增大压强
C.反应方程式中的x=1则30 min时表示增大压强
D.40 min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
S2Cl2是一种重要的化工产品。常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,易与水反应,进一步氯化可得SCl2,SCl2是樱桃红色液体,易挥发,熔点-122℃,沸点59℃。SCl2 与S2Cl2相似,有毒并有恶臭,但更不稳定。S2Cl2可用下列装置制备。
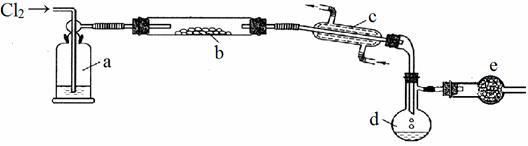
回答下列问题:
(1)写出S2Cl2的电子式_____________________;
(2)写出指定仪器的名称c___________________,d_________________________;
(3)a瓶盛放的试剂是_______________________ ;
(4)b中的反应开始前,需排除装置中的空气,应采取的方法是:_______________________;
(5)装置e中盛放的试剂是_____________其作用是①______________________________ ②___________________________________;
(6)得到纯净的S2Cl2,需要进行的操作是__________;
(7)若将S2Cl2放入水中同时产生沉淀和气体写出反应的方程式
___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com