
【题目】现有A、B、C三种烃,其球棍模型如图:
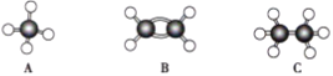
(1).等质量的以上物质完全燃烧时耗去O2的量最多的是______(填对应字母,下同)
(2).同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是______
(3).等质量的以上三种物质燃烧时,生成水最多的是______
(4).在120℃、1.01×105Pa条件下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是______。
【答案】A C A AB
【解析】
根据球棍模型,推出A为CH4,B为CH2=CH2,C为CH3-CH3,利用烃燃烧的规律进行;
(1).等质量的烃完全燃烧时,氢元素的质量分数越大,耗氧量越大,即CxHy写成![]() ,CH4、C2H4、C2H6中的
,CH4、C2H4、C2H6中的![]() 依次为
依次为![]() ,得出CH4耗氧量最多;
,得出CH4耗氧量最多;
(2).等物质的量的烃CxHy完全燃烧时,(x+![]() )的值越大,耗氧量越大,依次为2、3、3.5,故乙烷耗氧量最多,
)的值越大,耗氧量越大,依次为2、3、3.5,故乙烷耗氧量最多,
(3).根据(1)的分析,等质量的三种物质,CH4的含氢量最高,因此CH4生成的H2O最多
(4).温度大于或等于100℃条件下,水为气态,CxHy+(x+![]() )O2→xCO2+
)O2→xCO2+![]() H2O,该烃完全燃烧前后气体体积不变,1+x+
H2O,该烃完全燃烧前后气体体积不变,1+x+![]() =x+
=x+![]() ,解得y=4,故答案为CH4、C2H4;
,解得y=4,故答案为CH4、C2H4;


科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:
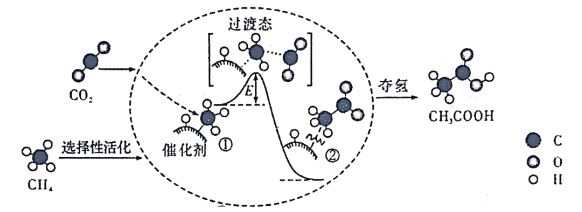 下列说法不正确的是( )
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂.
C.①→②过程吸收能量并形成了C—C键
D.该催化剂对该反应的平衡转化率无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
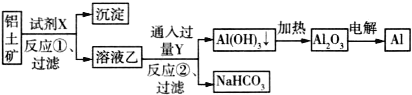
下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
D.图中所有反应都不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境保护是目前人类面临的一项重大课题。为应对燃料使用造成的环境污染,科学家提出了利用太阳能促进燃料循环使用的构想,其构想可用下图表示:
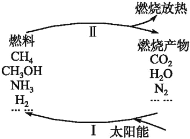
其中过程Ⅰ的主要反应为①2CO2![]() 2CO+O2,②2H2O
2CO+O2,②2H2O![]() 2H2↑+O2↑,③2N2+6H2O
2H2↑+O2↑,③2N2+6H2O![]() 4NH3+3O2,④2CO2+4H2O
4NH3+3O2,④2CO2+4H2O![]() 2CH3OH+3O2,⑤CO2+2H2O
2CH3OH+3O2,⑤CO2+2H2O![]() CH4+2O2。
CH4+2O2。
下列说法中不正确的是
A.过程Ⅱ中发生的反应均为放热反应
B.太阳能最终主要转化为热能
C.经过上述一个循环后放出O2
D.要实现上述循环,当前需要解决的关键问题是过程Ⅰ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造海绵的主要成分是聚氨酯,合成方法如下:
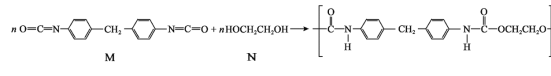
下列说法正确的是( )
A.M 属于芳香烃B.N 与乙醇互为同系物
C.合成聚氨酯的反应属于缩聚反应D.聚氨酯在一定条件下可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.1mol/L HCl溶液中由水电离出的H+的浓度为_______;
(2)若向氨水中加入少量硫酸铵固体,此时溶液中![]() 将_______;(填“增大”、“减小”或“不变”)
将_______;(填“增大”、“减小”或“不变”)
(3)25℃时,向AgNO3溶液中加入BaCl2溶液和KBr溶液,当两种沉淀共存时,![]() =____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
=____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
(4)用离子方程式表示NH4F不能用玻璃试剂瓶装的原因________;
(5)25℃时,有下列四种溶液:A. 0.1mol/L CH3COONH4溶液 B. 0.1mol/L CH3COOH溶液 C.0.1mol/L CH3COONa溶液 D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液(混合液呈酸性)
① 已知A溶液呈中性,试推断(NH4)2CO3溶液呈______性(填“酸”或“碱”或“中”);
② D溶液中除H2O外所有分子、离子浓度由大到小的顺序为________;
③ 上述四种溶液中水的电离程度由小到大的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前应用最广泛的氮氧化物脱除技术原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol。其他条件不变时,在2 L密闭容器中使用不同的催化剂X、Y、Z,产生n(N2)随时间的变化如下图所示。下列说法不正确的是
5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol。其他条件不变时,在2 L密闭容器中使用不同的催化剂X、Y、Z,产生n(N2)随时间的变化如下图所示。下列说法不正确的是
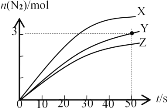
A.用催化剂X与Z,达到平衡时,N2产率一样
B.用催化剂Y前50 s平均反应速率v(NH3)=0.03 mol/(Ls)
C.分离出体系中的H2O(g)有利于提升氮氧化物的脱除率
D.若体系各物质状态保持不变,则反应在任何温度下均可自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代宋应星 《天工开物·铜》写到:“凡铜供世用,出山与出炉,止有赤铜。以炉甘石或倭铅参和,转色为黄铜;以砒霜等药制炼为白铜;矾、硝等药制炼为青铜;广锡参和为响铜;倭铅和写﹝泻﹞为铸铜。初质则一味红铜而已。”回答下列问题:
(1)古人描述的倭铅的主要成分不是铅,而是一种位于第四周期的过渡元素,其基态原子的第三能层的能级全部排满,其原子外围电子的排布式为:________________________
(2)在CuSO4溶液中加过量氨水后再向该溶液中加入一定量乙醇会析出[Cu(NH3)4]SO4·H2O,写出此过程中蓝色絮状沉淀滴加过量氨水的离子反应方程式________________________________________,[Cu(NH3)4]SO4·H2O中与Cu2+形成配位键的原子是________(填元素符号),若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是对其进行_________________实验。
(3)含有钡元素的盐的焰色反应为_______色,许多金属盐都可以发生焰色反应,其原因是______________________
(4)黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。四方晶系CuFeS2晶胞结构如图所示。
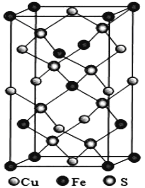
①Cu+的配位数为__________,
②已知:底边a=b=0.524 nm,高c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是___________gcm3(列出计算表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com