
A. | B. | C. | D. |
科目:高中化学 来源:不详 题型:单选题
| A.容器内压强不随时间的变化而变化 |
| B.X、Y、Z、W的浓度比保持不变 |
| C.X的消耗速率与Z的生成速率相等 |
| D.c(X)?c(Y)=c(Z)?c(W) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④ | B.①④⑥ | C.②③⑥ | D.②③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
| ||

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | ______ | 1.20×10-3 | ______ | 124 |
| Ⅲ | 350 | ______ | ______ | 82 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).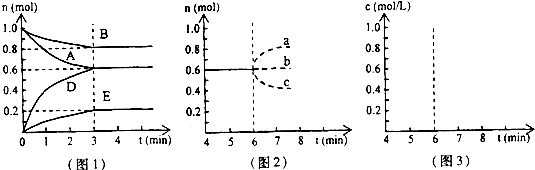
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.达平衡后,隔板K最终停留在左侧刻度0~2之间 |
| B.若平衡时K停留在左侧1处,则活塞停留在右侧6处 |
| C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量 |
| D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com