
| Q |
| n |
| 100×4.18(t2-t1)×10-3 |
| 0.025 |
| 100×4.18(t2-t1)×10-3 |
| 0.025 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、a=b=c |
| B、2a=2b=c |
| C、a=b=2c |
| D、都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 NaOH溶液:K+、Ba2+、Cl-、HCO3- |
| B、0.1 mol?L-1 Na2CO3溶液:K+、NH4+、NO3-、SO42- |
| C、0.1 mol?L-1 FeCl3溶液:K+、Na+、I-、SCN- |
| D、0.1 mol?L-1 HCl的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
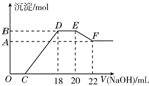 探究实验发现,硝酸发生氧化还原反应时,浓度越稀,对应还原产物中氮元素的化合价越低.
探究实验发现,硝酸发生氧化还原反应时,浓度越稀,对应还原产物中氮元素的化合价越低.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.50 mol?L-1盐酸,0.50 mol?L-1NaOH溶液,100 mL量筒1个 |
| B、0.50 mol?L-1盐酸,0.55 mol?L-1NaOH溶液,100 mL量筒2个 |
| C、0.50 mol?L-1盐酸,0.55 mol?L-1NaOH溶液,50 mL量筒1个 |
| D、0.50 mol?L-1盐酸,0.55 mol?L-1NaOH溶液,50 mL量筒2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M>N | B、M<N |
| C、M=N | D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质焰色反应呈黄色,结论:该物质是钠盐 |
| B、无色试液加入NaOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含NH3 |
| C、无色溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,结论:原溶液一定含有SO42- |
| D、无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液可能含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
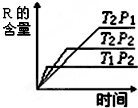 在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L,反应符合右图.下列叙述正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L,反应符合右图.下列叙述正确的是( )| A、T2>T1,正反应放热,L是液体 |
| B、P2<P1,正反应吸热,L是固体 |
| C、T2<T1,正反应放热,L是气体 |
| D、P2>P1,正反应吸热,L是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图1为实验室制取氨的实验装置.
如图1为实验室制取氨的实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com