
【题目】下列有关实验说法,不正确的是
A.苯酚不慎沾到皮肤上,应立即用酒精洗涤,再用大量水冲洗
B.KCl和MnO2的混合物经溶解、过滤、洗涤、干燥,可分离出MnO2
C.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D.火柴头的浸泡液中滴加AgNO3溶液、稀HNO3和NaNO2溶液,可检验火柴头是否含有氯元素
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是
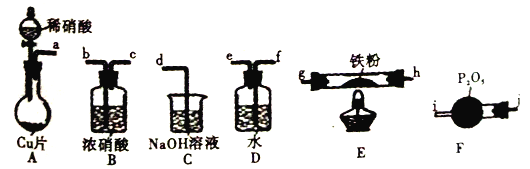
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
A. 装置的连接顺序为a![]() f
f![]() e
e![]() j
j![]() i
i![]() h
h![]() g(或g
g(或g![]() h)
h)![]() b
b![]() c
c![]() d
d
B. 装置E中发生的化学方程式为2NO+2Fe![]() 2FeO+N2
2FeO+N2
C. 装置D的作用是吸收挥发出来的硝酸和产生NO2
D. 装置B的作用是干燥,防止水蒸气进入E中干扰反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
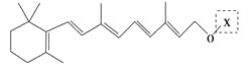
为了研究X的结构,将化合物A在一定条件下水解只得到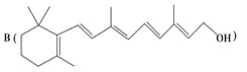 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。
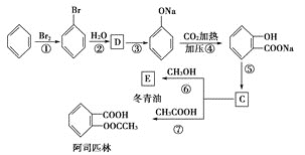
(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知2mol氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)=2H2O(l)。
①该反应的生成物能量总和__(填“大于”、“小于”或“等于”)反应物能量总和。
②若2mol氢气完全燃烧生成水蒸气,则放出的热量___(填“大于”、“小于”或“等于”)572 kJ。
(2)2.3g有机物C2H6O和一定量的氧气混合点燃,恰好完全燃烧,生成CO2和液态水,并放出68.35kJ热量,则该反应的热化学方程式是___。
(3)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
H2O(g)=H2O(l) ΔH2=-44kJ·mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是___。
(4)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点___(填“升高”还是“降低”),△H___(填“变大”、“变小”或“不变”)。
2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点___(填“升高”还是“降低”),△H___(填“变大”、“变小”或“不变”)。
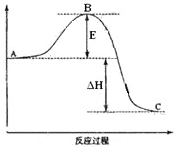
(5)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、___、量筒。量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还需加入的试剂是___(填序号)。
A.50 mL0.50mol·L-1NaOH溶液
B.50 mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是
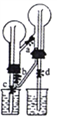
A. 在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B. 在实验室中制备干燥的氨气和氯化氢时,可选用相同的干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJmol-1
一种工业合成氨的简易流程图如图:
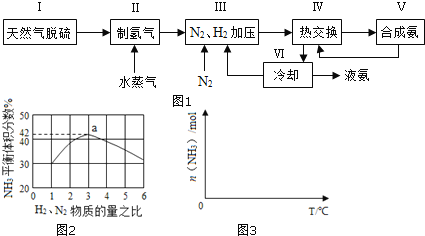
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJmol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJmol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___(填序号),简述本流程中提高合成氨原料总转化率的方法:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷![]() 、锑
、锑![]() 、铋
、铋![]() 、镆
、镆![]() 为元素周期表中原子序数依次增大的同族元素。回答下列问题:
为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为______。已知:
的中子数为______。已知:![]() (
(![]() ,白磷)=
,白磷)=![]() (
(![]() ,黑磷)
,黑磷) ![]() ;
;![]() (
(![]() ,白磷)=
,白磷)=![]() (
(![]() ,红磷)
,红磷) ![]() ; 由此推知,其中最稳定的磷单质是______。
; 由此推知,其中最稳定的磷单质是______。
(2)氮和磷氢化物性质的比较:热稳定性:![]() ______
______![]() (填“>”“<”)。 沸点:
(填“>”“<”)。 沸点:![]() ______
______![]() (填“>”“<”),判断依据是______。
(填“>”“<”),判断依据是______。
(3)![]() 和
和![]() 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对![]() 与
与![]() 反应产物的推断正确的是______(填序号)。
反应产物的推断正确的是______(填序号)。
a.不能与![]() 反应 b.含离子键、共价键 c.能与水反应
反应 b.含离子键、共价键 c.能与水反应
(4)![]() 能发生较烈的水解,生成难溶的
能发生较烈的水解,生成难溶的![]() ,写出该反应的化学方程式 ______________,因此,配制
,写出该反应的化学方程式 ______________,因此,配制![]() 溶液应注意_____________。
溶液应注意_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com