
| 化学键 | C-H | C=C | C-C | H-H |
| 键能 (kJ/mol) | 414 | 615 | 347 | 435 |
分析 (1)依据热化学方程式和盖斯定律计算,①-②得到HCN在水溶液中电离的热化学方程式;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)利用压强之比等于物质的量之比,求出3min末时容器内混合气体的物质的量,根据方程式利用差量法计算氮气的物质的量变化量,在依据化学方程式计算对应反应放出的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式.
解答 解:(1)①HCN(aq)+NaOH(aq)=NaCN (aq)+H2O(l)△H=-12.1kJ/mol
②HCl(aq)+NaOH(aq)=NaCl (aq)+H2O(l)△H=-55.6kJ/mol
盖斯定律计算得到,①-②得到HCN在水溶液中电离的热化学方程式:HCN(aq)=H+(aq)+CN-(aq)△H=+43.5kJ/mol,
故答案为:HCN(aq)=H+(aq)+CN-(aq)△H=+43.5kJ/mol;
(2)在反应CH3-CH3→CH2=CH2+H2中,断裂6mol C-H键,1mol C-C键共吸收的能量为:6×414kJ+347kJ=2831kJ,
生成1molCH2=CH2和1molH2,共形成4molC-H键,1molC=C、1molH-H,共放出的能量为:4×414kJ+615kJ+435kJ=2706kJ,
吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2831kJ-2706kJ=125,所以反应热为+125kJ/mol,
故答案为:+125 kJ/mol;
(3)在1L的密闭容器中充入1molN2气和3molH2气体,在一定条件下发生反应:一段时间后,测得容器内混合气体的压强是反应前的0.9倍,此时体系放热a KJ
N2(g)+3H2(g)=2NH3(g)
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
容器内混合气体的压强是反应前的0.9倍,即气体物质的量关系,(1-x+3-3x+2x):(1+3)=0.9
x=0.2mol,
则1mol氮气完全反应放热5aKJ,热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-5akJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-5akJ/mol.
点评 本题考查反应热的计算,热化学方程式书写,题目难度不大,注意把握从键能的角度计算反应热的方法,掌握基础是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的金属性、非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是第二周期元素 | B. | 一定是同一主族元素 | ||
| C. | 可能是第二、三周期元素 | D. | A、B只能形成化合物B2A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
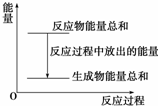 对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )| A. | Zn和H2SO4的总能量大于ZnSO4和H2的总能量 | |
| B. | 反应过程中能量关系可用如图表示 | |
| C. | 若将该反应设计成原电池,则Zn为负极 | |
| D. | 若将该反应设计成原电池,当有32.5g锌溶解时,正极放出11.2 L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物总能量低于生成物总能量时,该反应一定不能发生 | |
| B. | 化学键的键能越大,物质的能量越高 | |
| C. | 一个反应的焓变因反应物的用量和反应条件的改变而发生改变 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入含HClO的溶液中生成H2SO4 HClO的酸性比H2SO4强 | |
| B. | 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔表面氧化铝熔点高于铝 | |
| C. | SiO2可以和碱溶液及酸溶液反应 SiO2属于两性氧化物 | |
| D. | 将SO2通入溴水中,溴水褪色 SO2具有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com