
��2L�ܱ������У�����X��Y��4mol��һ�������·�����ѧ��Ӧ��2X��g��+ 2Y��g��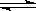 Z��g��+2 W��g�� ��H<0��
��Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
Z��g��+2 W��g�� ��H<0��
��Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
A��5s��ƽ����Ӧ����Ϊ��(Y)= 0.2 mol/( L��s)
B���÷�Ӧ��ƽ�ⳣ����ֵΪ0.5
C�������ݻ�������䣬��������ͨ������������߷�Ӧ���ת����
D�������¶ȣ�������������ܶȲ���ʱ����ʾ�÷�Ӧ�Ѿ��ﵽƽ��״̬

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2011?��������ģ��������Ԫ��A��B��C��D��E��F��G�������������������࣬Aԭ����Ԫ���е����������ٵģ�B�������������Ǵ����������Ķ�����C����������������Ӳ�����������G��Cͬ������Ԫ�غ����������֮����D��E��Ԫ�غ����������֮����ȣ�F������������Ǵ����������Ķ���֮һ��
��2011?��������ģ��������Ԫ��A��B��C��D��E��F��G�������������������࣬Aԭ����Ԫ���е����������ٵģ�B�������������Ǵ����������Ķ�����C����������������Ӳ�����������G��Cͬ������Ԫ�غ����������֮����D��E��Ԫ�غ����������֮����ȣ�F������������Ǵ����������Ķ���֮һ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| [O2][H2]2 |
| [H2O]2 |
| [O2][H2]2 |
| [H2O]2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ������к�ƽ��������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
���ǵ����Ϻ����ḻ�ġ���Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
����N ���������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ��

(1)��ͼ��1molNO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ________________________________________��
��֪��N2(g)+ O2(g)��2NO(g)? ��H����180kJ/mol��2NO(g)+O2(g)��2NO2(g)? ��H����112.3kJ/mol����Ӧ2NO(g)+2CO(g) N2(g)+ 2CO2(g)�ġ�H��_______________��
N2(g)+ 2CO2(g)�ġ�H��_______________��
(2)һ���¶��£���2L�ܱ�������NO2��O2�ɷ������з�Ӧ��4NO2(g) + O2(g) 2N2O5(g)����֪��ϵ��n(NO2)��ʱ��仯���±���
2N2O5(g)����֪��ϵ��n(NO2)��ʱ��仯���±���
t(s) | 0 | 500 | 1000 | 1500 |
n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��__________����֪��K300����K350������÷�Ӧ��______�ȷ�Ӧ��
�ڷ�Ӧ�ﵽƽ���NO2��ת����Ϊ________________����ʱ����ͨ��һ������������NO2��ת���ʽ�___________�����������С���������䡱����
��ͼ�б�ʾN2O5��Ũ�ȵı仯������____����O2��ʾ��0��500 s�ڸ÷�Ӧ��ƽ������v��________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ɽ��ʡ������ ���ͣ������
 2SO3��g����H<0
2SO3��g����H<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�걱���д������߿���ѧ��ģ�Ծ��������棩 ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com