
| A. | 电解时,阳极反应为:Fe-2e-=Fe2+ | |
| B. | 电解过程中阴极能产生氢气 | |
| C. | 电解过程中,Cr2O72-在阳极放电 | |
| D. | 电解过程中,溶液中生成Cr(OH)3和Fe(OH)3沉淀 |
分析 A.电解时,铁为阳极,则阳极上铁失去电子;
B.溶液中的氢离子在阴极放电生成氢气、NaOH;
C.电解时,铁为阳极,阳极上铁失去电子生成亚铁离子;
D.阳离子向阴极移动,且阴极生成碱.
解答 解:A.铁为电极,则阳极上铁失去电子,则发生Fe-2e-=Fe2+,故A正确;
B.溶液中的氢离子在阴极放电生成氢气、NaOH,故B正确;
C.电解时,铁为阳极,阳极上铁失去电子生成亚铁离子,生成的亚铁离子具有还原性,和水中的重铬酸根离子发生氧化还原反应,故C错误;
D.由C可知,反应中生成的阳离子向阴极移动,且阴极生成碱,则在阴极附近生成Cr(0H)3和Fe(0H)3沉淀,故D正确;
故选C.
点评 本题考查电解原理,明确电解过程中离子的移动及离子的放电顺序、发生的电极反应是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
 298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极反应为:Zn-2e-→Zn2+ | B. | 盐桥中K+向右池移动 | ||
| C. | Pt电极上有气泡出现 | D. | 左烧杯中溶液的红色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe2+与足量的H2O2溶液反应,转移2nA个 | |
| B. | 1L0.1mol•L-1的氨水含有0.1nA个OH- | |
| C. | 常温常压下,22.4LCCl4含有个nA个CCl4分子 | |
| D. | 常温下,23g NO2含有nA个氧原子电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液, 振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②, 振荡 | ③ | 存在Fe2+ |
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 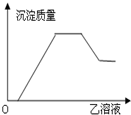 | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH | |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C. D.
D.
 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
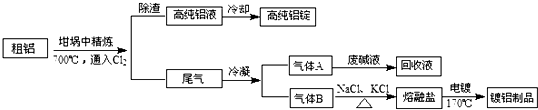
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com