
SO2是硫酸工业尾气的主要成分。实验室中,拟用如图所示流程,测定标准状况下体积为V L的硫酸工业尾气中SO2的含量。
(1)步骤①中加入H2O2溶液时发生反应的离子方程式为____________________,1 mol H2O2参加反应,转移的电子数为________。
(2)步骤③的操作依次是过滤、________、________、称重。

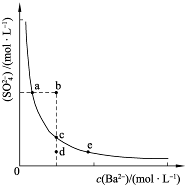
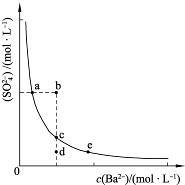
(3)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示。步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数________(填“增大”、“减小”或“不变”),溶液中SO42-浓度的变化情况为________(填序号)。
①d→c→e??????? ②b→c→d????? ③a→c→e???? ④d→c→a
(4)该V L尾气中SO2的体积分数为________(用含有V、m的代数式表示)。
(1)H2O2+SO2=2H++SO42- 1.204×1024
(2)洗涤 干燥
(3)不变 ③ 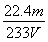 ×100%
×100%
【解析】(1)H2O2具有氧化性,能与SO2发生氧化还原反应,离子方程式为H2O2+SO2=2H++SO42-,1 mol H2O2参加反应,转移2 mol电子。
(2)步骤③将沉淀过滤洗涤、干燥后称重。
(3)在滴加Ba(OH)2溶液的过程中,溶液的温度不变,Ksp不变,BaSO4在溶液中存在沉淀溶解平衡:BaSO4(s)??Ba2+(aq)+SO42- (aq),加入Ba(OH)2溶液后,c(Ba2+)增大,但Ksp=c(Ba2+)·c(SO42-)不变,故c(SO42-)逐渐减小。由于温度不变,所以c(Ba2+)、c(SO42-)均在曲线上。
(4)根据S元素守恒有:SO2~BaSO4。据此可知SO2的物质的量为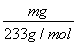 ,则标准状况下V L尾气中SO2的体积分数为
,则标准状况下V L尾气中SO2的体积分数为 ×100%=
×100%=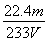 ×100%。
×100%。


科目:高中化学 来源: 题型:
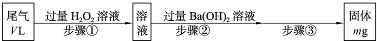
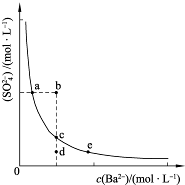
| O | 2- 4 |
| m×22.4 |
| 233V |
| m×22.4 |
| 233V |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

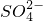 浓度的变化情况为______(填序号)
浓度的变化情况为______(填序号)查看答案和解析>>
科目:高中化学 来源:济南二模 题型:问答题
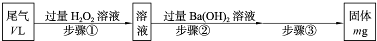
| O | 2-4 |
查看答案和解析>>
科目:高中化学 来源:2012年山东省济南市高考化学二模试卷(解析版) 题型:解答题

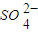 浓度的变化情况为______(填序号)
浓度的变化情况为______(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com