
 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )| A、镁铝合金的质量为0.39 g |
| B、盐酸的物质的量浓度为2mol/L |
| C、B点沉淀的质量 0.39g |
| D、镁铝与盐酸恰好完全反应 |
| n |
| V |
| 0.05mol |
| 0.1L |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
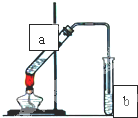 (Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.
(Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.| 催化剂 |
| Ⅰ |
| Ⅱ |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2912 kJ |
| B、2953 kJ |
| C、3236 kJ |
| D、3867 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体系的压强保持不变 |
| B、H2与I2的体积比保持不变 |
| C、混合气体的颜色保持不变 |
| D、每消耗1molH2的同时生成2molHI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al跟NaOH溶液共热 |
| B、Al(NO3)3跟过量的NaOH溶液 |
| C、A12O3和水共热 |
| D、A12(SO4)3和过量的NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
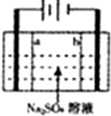 近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产NaOH和H2SO4,下列主产法中不正确的是( )
近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产NaOH和H2SO4,下列主产法中不正确的是( )| A、阴极反应式4OH--4e-=2H2O+O2↑ |
| B、阴极得到NaOH,阳极得到H2SO4 |
| C、每生产1molH2SO4,同时得到2mol NaOH |
| D、此反应实质就是电解水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用洁净的玻璃棒蘸取试液,点在湿润的pH 试纸上测定试液pH |
| B、在含有FeCl2杂质的FeCl3溶液中通入足量Cl2后,充分加热,除去过量的Cl2,即可得到纯净的FeCl3溶液 |
| C、用25mL 酸式滴定管量取18.00mL KMnO4溶液 |
| D、为减小中和滴定误差,锥形瓶必须洗净烘干并用待测液润洗后才能使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com