
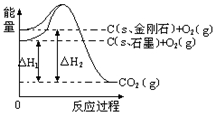
| A. | 石墨和金刚石互为同位素 | |
| B. | 金刚石的总能量比石墨的总能量高1.9 kJ | |
| C. | C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1 | |
| D. | C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1 |
分析 由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,据此进行解答.
解答 解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,
A.石墨和金刚石是由同一种元素组成的不同单质,互为同素异形体,故A错误;
B.根据C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1可知,1mol金刚石具有的总能量比1mol石墨具有的总能量高1.9 kJ,没有指出二者物质的量,该说法不合理,故B错误;
C.热化学方程式中必须标出物质状态,故C错误;
D.根据分析可知C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故D正确;
故选D.
点评 本题考查反应热与焓变的应用,题目难度不大,明确物质的稳定性与能量的关系为解答关键,注意掌握盖斯定律的内容及应用方法.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
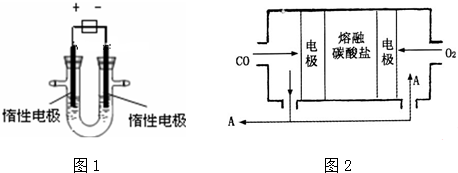
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲=乙>丙 | B. | 丙>甲=乙 | C. | 甲>乙>丙 | D. | 甲>丙>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
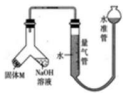 某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 波长最长 | B. | 波长最短 | C. | 平均波长 | D. | 中间波长 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com